题目内容
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径,由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
回答下列问题:
(1)反应Ⅱ的△H2=______ ,反应 I自发进行条件是 ______(填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下3 L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。
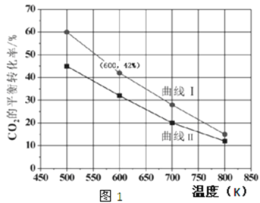
①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3 mol,n(CO2)=1.5 mol B:n(H2)=3 mol,n(CO2)=2 mol,
曲线 I代表哪种投入方式______(用A、B表示)。
②在温度为500K的条件下,按照A方式充入3 molH2和1.5 molCO2,该反应10 min时达到平衡:
a.此温度下的平衡常数为______;500K时,若在此容器中开始充入0.3 mol H2和0.9 molCO2、0.6 mol CH3OH、x mol H2O,若使反应在开始时正向进行,则x应满足的条件是 ______。
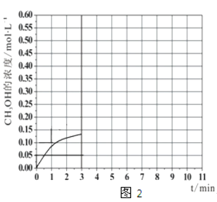
b.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3 min时,迅速将体系温度升至600 K,请在图2中画出3~10 min内容器中CH3OH浓度的变化趋势曲线__________。
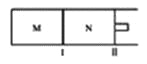
(3)化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应,图3是甲醇燃料电池的模型。
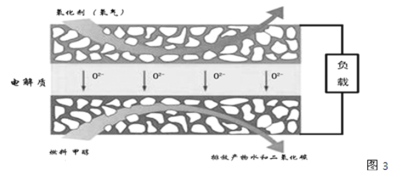
①写出该燃料电池的负极反应式 ______。
②如果用该电池作为电解装置,当有16 g甲醇发生反应时,则理论上提供的电量最多为 ______(法拉第常数为9.65×104C/mol)
【答案】+41.19 kJ/mol 较低温 A 450 0<x<2.025  CH3OH-6e-+3O2-=CO2↑+2H2O 2.895×105 C
CH3OH-6e-+3O2-=CO2↑+2H2O 2.895×105 C
【解析】
(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应自发进行的判断依据是△G=△H-T△S<0;
(2)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②a.根据物质反应的转换关系计算;
b.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲醇失电子发生氧化反应,结合导电离子和电荷守恒分析书写;
②依据电极反应计算转移电子数,结合法拉第常数为9.65×104C/mol计算电量。
(1)反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.58kJ/mol
CH3OH(g)+H2O(g)△H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2
CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58 kJ/mol)-(-90.77kJ/mol)=+41.19 kJ/mol;根据反应自发行的判据:△G=△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行;
(2)①A:n(H2)=3 mol,n(CO2)=1.5 mol,B:n(H2)=3 mol,n(CO2)=2 mol,二者比较,B相当于增大二氧化碳的量,平衡正向移动,但CO2的转化率反而降低,转化率小于A,所以曲线该I代表A的投料;
②在温度为500K的条件下,在3 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,该反应10 min时达到平衡,二氧化碳的转化率是60%,则转化的CO2物质的量浓度为△c(CO2)= ![]() ×60%=0.3 mol/L,根据反应方程式CO2(g)+3H2(g)
×60%=0.3 mol/L,根据反应方程式CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中物质反应关系可知,△c(H2)= 3△c(CO2)=0.9 mol/L,△c(CH3OH)=△c(H2O)=△n(CO2)=0.3mol/L,所以各种物质的平衡浓度:c(CO2)=(0.5-0.3) mol/L=0.2 mol/L,c(H2)=(1-0.9)mol/L=0.1mol/L;c(CH3OH)=c(H2O)=0.3 mol/L,所以
CH3OH(g)+H2O(g)中物质反应关系可知,△c(H2)= 3△c(CO2)=0.9 mol/L,△c(CH3OH)=△c(H2O)=△n(CO2)=0.3mol/L,所以各种物质的平衡浓度:c(CO2)=(0.5-0.3) mol/L=0.2 mol/L,c(H2)=(1-0.9)mol/L=0.1mol/L;c(CH3OH)=c(H2O)=0.3 mol/L,所以
a.该温度下,反应I的平衡常数K=![]() =450,500K时,若在此容器中开始充入0.3molH2和0.9 mol CO2、0.6 mol CH3OH、x mol H2O,浓度分别为0.1 mol/L,0.3 mol/L,0.2 mol/L,
=450,500K时,若在此容器中开始充入0.3molH2和0.9 mol CO2、0.6 mol CH3OH、x mol H2O,浓度分别为0.1 mol/L,0.3 mol/L,0.2 mol/L,![]() mol/L,若使反应在开始时正向进行,浓度商Qc=
mol/L,若使反应在开始时正向进行,浓度商Qc= <K=450,x=2.025,所以x应满足的条件是0<x<2.025;
<K=450,x=2.025,所以x应满足的条件是0<x<2.025;
b.当反应时间达到3min时,迅速将体系温度升至600K,反应正向进行,反应速率加快,反应产生更多的甲醇,甲醇的浓度会增加,图象为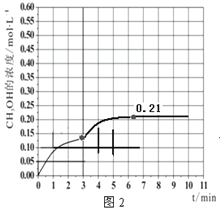 。
。
(3)①以固体氧化锆氧化钇为电解质这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲醇失去电子,发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O;
②16g甲醇物质的量n(CH3OH)= ![]() =0.5 mol,则其发生反应时转移电子的物质的量n(e-)=0.5 mol×6=3 mol,因此理论上提供的电量最多Q=3 mol×9.65×104 C/mol=2.895×105 C。
=0.5 mol,则其发生反应时转移电子的物质的量n(e-)=0.5 mol×6=3 mol,因此理论上提供的电量最多Q=3 mol×9.65×104 C/mol=2.895×105 C。

【题目】在一定条件下,将A和B各0.32 mol充入10 L的恒容密闭容器中,发生如下反应:A(s)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.反应前2 min的平均反应速率v(C)=0.004 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前,v(逆)>v(正)
C.其他条件不变,起始时向容器中充入各0.64 mol的A和B,平衡时n(C)<0.48 mol
D.其他条件不变,向平衡体系中再充入0.32 mol B和0.16 mol C,再达到平衡时,A的转化率增大
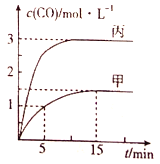
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
|
容积/L | 1 | 1 | V | |
温度/℃ | T1 | T2 | T1 | |
起始量 | 2 molC(s)、2 mol H2O(g) | 2 mol CO(g)、2 mol H2(g) | 6 molC(s)、 4mol H2O(g) |
下列说法正确的是( )
A.甲容器中,0~5min内的平均反应速率v(CO)=0.1 mol/(L·min)
B.乙容器中,若平衡时n(C)=0.56 mol,则T2>T1
C.温度为T1时,反应的平衡常数为K=9
D.丙容器的容积V=0.8 L