题目内容
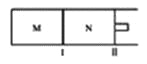
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。

下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
【答案】C
【解析】
根据图像可知,放电时,b极,锌失电子生成锌离子,作电池的负极;a极I2Br-得电子生成溴离子和碘离子。
A. 放电时,a电极作正极,I2Br-得电子生成溴离子和碘离子,反应为I2Br-+2e- =2I-+ Br-,与题意不符,A错误;
B. 放电时,负极:Zn-2e-=Zn2+,正极:I2Br-+2e- =2I-+ Br-,溶液中离子的数目增大,与题意不符,B错误;
C. 充电时,b电极生成Zn,每增重0.65g,即生成0.01molZn,则转移0.02mol电子,阳极发生2I-+Br--2e-=I2Br-,溶液中有0.02molI-被氧化,故C正确;
D. 充电时,a电极作阳极,与外电源正极相连,与题意不符,D错误;
答案为C。

【题目】化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
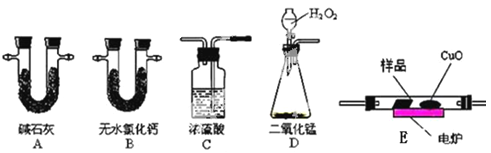
实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________,与该有机物相对分子质量相同的烃的一氯代物有_____种。