题目内容
【题目】(1)![]() 橙色
橙色![]() 在水中会部分转化为
在水中会部分转化为![]() 黄色
黄色![]() ,该过程可用离子反应方式表示为: ______ ;在
,该过程可用离子反应方式表示为: ______ ;在![]() 溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色,该过程可用化学反应方式表示为: ______ 。
溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色,该过程可用化学反应方式表示为: ______ 。
(2)水合草酸晶体的组成可表示为![]() ,为测定x的值,做了如下实验:
,为测定x的值,做了如下实验:
①称取Wg纯草酸晶体,将其配制成100mL水溶液为待测液;
②取25mL待测液放入锥形瓶中,再加入适量的稀![]() ;
;
③用浓度为a![]() 的
的![]() 标准溶液进行滴定
标准溶液进行滴定![]() 滴定过程中有
滴定过程中有![]() 、
、![]() 生成
生成![]() ,
,
请回答:①写出滴定时发生的反应的离子方程式为: ______ ,
②滴定时,将![]() 标准液装在 ______ 式滴定管中,
标准液装在 ______ 式滴定管中,
③假设滴定终点时,用去VmL![]() 溶液,则待测草酸溶液的物质的量浓度为 ______
溶液,则待测草酸溶液的物质的量浓度为 ______ ![]() ,
,
④在上述实验中,下列操作![]() 其他操作正确
其他操作正确![]() 会造成测定结果x值偏高的有 ______
会造成测定结果x值偏高的有 ______ ![]() 填字母
填字母![]() ,
,
A、滴定终点读数时俯视读数B、酸式滴定管使用前,水洗后未用标准液润洗
C、锥形瓶水洗后再用待测液润洗D、滴定时所用的![]() 溶液因久置而导致浓度变小。
溶液因久置而导致浓度变小。
【答案】![]()
![]()
![]() 酸式
酸式 ![]() A
A
【解析】
(1)![]() (橙色)在水中会部分转化为
(橙色)在水中会部分转化为![]() (黄色),重铬酸根离子和水反应生成铬酸根离子和氢离子;在
(黄色),重铬酸根离子和水反应生成铬酸根离子和氢离子;在![]() 溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色说明平衡正向进行生成铬酸钠、铬酸钾和水;
溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色说明平衡正向进行生成铬酸钠、铬酸钾和水;
(2)①.高锰酸钾溶液具有氧化性氧化草酸为二氧化碳;
②.高锰酸钾具有强氧化性,会腐蚀碱式滴定管中的橡皮管,应装在酸式滴定管中;
③.根据![]() 进行解答;
进行解答;
④.依据c(待测)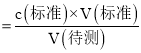 ,结合选项分析判断。
,结合选项分析判断。
(1)![]() (橙色)在水中会部分转化为
(橙色)在水中会部分转化为![]() (黄色),该过程可用离子反应方式表示为:
(黄色),该过程可用离子反应方式表示为:![]() ;在
;在![]() 溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色,该过程可用化学反应方式表示为:
溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色,该过程可用化学反应方式表示为:![]() ;
;
故答案为:![]() ;
;![]() ;
;
(2)①.滴定时发生的反应是高锰酸钾氧化草酸为二氧化碳,反应的离子方程式为:![]() ;
;
故答案为:![]() ;
;
②.![]() 溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故
溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故![]() 溶液应装在酸式滴定管中,
溶液应装在酸式滴定管中,
故答案为:酸式;
③.根据![]() 知,草酸的物质的量浓度
知,草酸的物质的量浓度 ,
,
故答案为:![]() ;
;
④.用浓度为a![]() 的
的![]() 标准溶液进行滴定
标准溶液进行滴定
A、滴定终点读数时俯视读数,读取标准溶液体积减小,计算出的草酸物质的量偏低,计算出的x偏高,故A符合题意;
B、酸式滴定管使用前,水洗后未用标准液润洗,标准溶液浓度减小,消耗标准溶液体积增大,计算出草酸的量增大,计算出的x值偏低,故B不符合题意;
C、锥形瓶水洗后再用待测液润洗,消耗标准溶液体积增大,计算出草酸的量增大,计算出的x值偏低,故C不符合题意;
D、滴定时所用的![]() 溶液因久置而导致浓度变小,消耗标准溶液体积增大,计算出草酸的量增大,计算出的x值偏低,故D不符合题意;
溶液因久置而导致浓度变小,消耗标准溶液体积增大,计算出草酸的量增大,计算出的x值偏低,故D不符合题意;
故答案为:A。

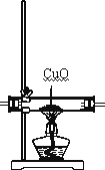
【题目】化学上常用燃烧法测定有机物的分子式,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。

实验探究小组称取一定质量的样品(只含C、H、O三种元素中的两种或三种),进行实验,通过测定产生的CO2和水的质量确定有机物的组成,请回答下列问题:
(1)C中浓硫酸的作用是除去氧气中的水蒸气,实验装置的连接顺序应是:___________(每种装置只用一次);
(2)实验数据记录和处理
物理量实验序号 | 燃烧有机物的质量 | ① | ② | ||
实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
1 | m1 | m2 | m3 | m4 | m5 |
上表中①、②分别指哪个装置?____________ 、 _____________。
(3)若实验准确称取4.4 g样品,经燃烧后测得产生CO28.8 g,水蒸气3.6g。要确定该有机物的分子式,还必须知道的数据是________;
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式___________,与该有机物相对分子质量相同的烃的一氯代物有_____种。
【题目】石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素。据报道,中国宣布将推广“车用乙醇汽油”。
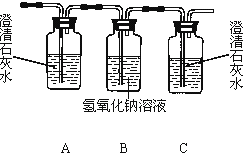
(1)乙醇燃烧时如果氧气不足,可能还有CO生成.用下图装置正确验证乙醇燃烧产物有CO、![]() 、
、![]() ,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号______。
,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号______。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是______;B瓶溶液的作用是______。
(3)装置①中所盛的是______溶液,证明燃烧产物中含有CO的实验现象是:______。
(4)装置④中所盛的固体药品是______,它可以验证的产物是______。
【题目】在一定条件下,将A和B各0.32 mol充入10 L的恒容密闭容器中,发生如下反应:A(s)+B(g)![]() 2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
2C(g) △H<0,反应过程中测定的数据如表,则下列说法正确的是
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.反应前2 min的平均反应速率v(C)=0.004 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前,v(逆)>v(正)
C.其他条件不变,起始时向容器中充入各0.64 mol的A和B,平衡时n(C)<0.48 mol
D.其他条件不变,向平衡体系中再充入0.32 mol B和0.16 mol C,再达到平衡时,A的转化率增大