题目内容
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
分析 A.碘离子和次氯酸根离子发生氧化还原反应;
B.酚酞试液呈红色的溶液呈碱性;
C.c(H+)=10-12mol•L-1的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
D.加入铝粉产生氢气的溶液为弱氧化性酸或碱溶液.
解答 解:A.I-、ClO-发生氧化还原反应生成碘和氯离子而不能大量共存,故A错误;
B.酚酞试液呈红色的溶液呈碱性,Al3+和OH-反应生成沉淀而不能大量共存,故B错误;
C.c(H+)=10-12mol•L-1的溶液呈碱性,这几种离子之间不反应且和OH-也不反应,所以能大量共存,故C正确;
D.加入铝粉产生氢气的溶液为弱氧化性酸或碱溶液,酸性条件下HCO3-不能大量共存,碱性条件下Mg2+、HCO3-不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高考高频点,侧重考查氧化还原反应、复分解反应,明确离子性质结合溶液酸碱性分析解答,易错选项是A.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
11.某同学利用如图所示的实验装置进行铁跟水蒸气反应的实验.

请回答下列问题:
(1)硬质试管中发生的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)检验实验中所产生气体的方法是将所得的气体在导管出口处点燃,导管上方罩一个干燥的烧杯,若产生淡蓝色的火焰同时烧杯内壁出现水珠,证明产生的气体是氢气.
(3)如果要测量实验中产生的气体体积,可以采用下列实验装置,请将虚线内装置图的导管补充完整.(在答题卡上作图)
(4)某同学对反应后硬质试管中剩余固体物质的成分进行了研究,设计了如下实验.(实验限选试剂:盐酸,NaOH溶液、FeCl3溶液、KMnO4溶液、CuSO4溶液、KSCN溶液)

请回答下列问题:
(1)硬质试管中发生的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)检验实验中所产生气体的方法是将所得的气体在导管出口处点燃,导管上方罩一个干燥的烧杯,若产生淡蓝色的火焰同时烧杯内壁出现水珠,证明产生的气体是氢气.
(3)如果要测量实验中产生的气体体积,可以采用下列实验装置,请将虚线内装置图的导管补充完整.(在答题卡上作图)

(4)某同学对反应后硬质试管中剩余固体物质的成分进行了研究,设计了如下实验.(实验限选试剂:盐酸,NaOH溶液、FeCl3溶液、KMnO4溶液、CuSO4溶液、KSCN溶液)
| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
9.2010年以来我国严格抑制了稀土资源的开发和出口,从而引起了美国等西方国家的不满和恐慌.下列有关稀土资源${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm和${\;}_{62}^{150}$Sm的核外电子数和中子数均为62 |
16.能证明乙醇分子中含有一个羟基的事实是( )
| A. | 乙醇完全燃烧生成水 | |
| B. | 乙醇容易挥发 | |
| C. | 乙醇能与水以任意比例互溶 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是( )
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 磷酸二氢根电离的离子方程式:H2PO4-+H2O?H3O++HPO42- | |
| C. | 少量碳酸氢钙溶液与氢氧化钠溶液混合的离子方程式Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| D. | 在0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:CrO72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$ |
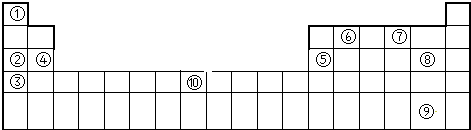
13.短周期元素X、Y、Z、W的原子序数依次增大,X、Y、Z的原子序数之和是W的2倍,X、Z在周期表中的相对物质如图所示,X的最低负价绝对值与其原子的最外层电子数相等.下列说法正确的是( )
| X | |||
| Z |
| A. | 离子半径:r(Y)>r(Z)>r(W) | |
| B. | Z的简单离子能破坏水的电离平衡 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z的简单气态氢化物的热稳定性比W的强 |
10.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液显碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等.则下列说法正确的是( )
| A. | 离子半径:丙>丁>乙 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均只有一种 |
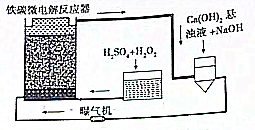 铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.
铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.