题目内容
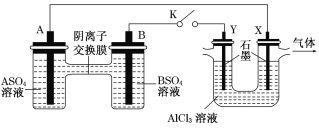
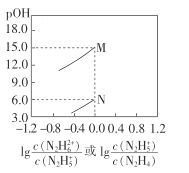
【题目】常温下,将盐酸滴加到联氨(N2 H4)的水溶液中,混合溶液中pOH[pOH=- lgc(OH- )]随离子浓度变化的关系如图所示。下列叙述正确的是(已知N2H4在水溶液中的电离方程式:N2H4+H2O- ![]() N2H5++OH- ,N2H5+ +H2O-
N2H5++OH- ,N2H5+ +H2O- ![]() N2H62++OH- )
N2H62++OH- )
A.联氨的水溶液中不存在H+
B.曲线M表示pOH与![]() 的变化关系
的变化关系
C.反应N2H4+H2O![]() N2H5++OH-的K=10-6
N2H5++OH-的K=10-6
D.N2H5Cl的水溶液呈碱性
【答案】C
【解析】
A. 联氨的水溶液中,水可以电离出H+,故A错误;
B. 当c(N2H5+)=c(N2H4)时,Kb1=c(OH-),同理c(N2H6+)= c(N2H5+)时,Kb2=c(OH-),所以曲线N表示pOH与![]() 的变化关系,曲线M表示pOH与
的变化关系,曲线M表示pOH与![]() 的变化关系,故B错误;
的变化关系,故B错误;
C. c(N2H5+)=c(N2H4)时,反应N2H4+H2O![]() N2H5++OH-的K=
N2H5++OH-的K=![]() =10-6,故C正确;
=10-6,故C正确;
D. N2H4在水溶液中不能完全电离,则N2H5Cl属于强酸弱碱盐,水溶液呈酸性,故D错误;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目