��Ŀ����
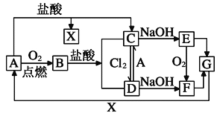
����Ŀ���ҹ���ѧ�Һ�°������������Ƽ��Ϊ�����Ƽҵ�����˾��ס���ͼΪ�����Ƽ����Ҫ���̣�������������ȥ����
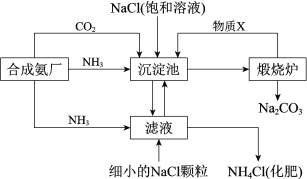
���ϣ������������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl
�����ܽ��
���� | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20��C�ܽ��/g | 36.0 | 21.7 | 9.6 | 37.2 |
��1������¯�з�Ӧ�Ļ�ѧ����ʽ��___������X��___���ѧʽ����
��2������˵����ȷ����__������ĸ����
A������������NaHCO3��������Ϊһ��������NaHCO3���ܽ����С
B����Һ����Ҫ����NaCl��Na2CO3��NH4Cl
C�����ѭ����Ŀ�������ԭ�ϵ�������
��3����ҵ���ô�������ռ�����ijЩ������Ʒ�����ñ��ʹ�����Һ��Cl2��Ӧ���Ƶ�һ�������������г�����Ư�ס����������ʣ�ͬʱ��NaHCO3���ɣ��÷�Ӧ�Ļ�ѧ����ʽ��___��
��4��ij������Ʒ�к�����NaCl��ȡ����Ϊag����Ʒ������������ϡ���ᣬ��ַ�Ӧ���ȡ����ɡ����գ��õ�bg�������ʣ������Ʒ��Na2CO3����������Ϊ__��
���𰸡�2NaHCO3![]() Na2CO3+CO2��+H2O CO2 AC 2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3
Na2CO3+CO2��+H2O CO2 AC 2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3 ![]() ��100%
��100%
��������
��1���������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl��������¯�жԳ������γɵ�̼�����ƽ��и������շֽ�����̼���ơ�������̼��ˮ������ͼʾ����¯�в���������X�����ڳ����ص�ѭ��ʹ�ã�������X��CO2��
��2��A. ��������ṩ���ܽ�ȱ������ϣ�����������NaHCO3��������Ϊһ��������NaHCO3���ܽ����С��
B. �������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl�����˺���Һ����Ҫ���е���NH4Cl��
C. �����غ�����¯�з�Ӧ�õ��IJ��ﶼ����Ϊ��ȡ�����ԭ�ϣ������ѭ����Ŀ�������ԭ�ϵ������ʣ�
��3���������⣬�ɽ���Ӧ������������������������ˮ��Ӧ��������ʹ����ᣬ����ʹ���������̼������Һ��Ӧ���ɴ������ƺ�̼�����ƣ�
��4��ag����Ʒ������������ϡ���ᣬ̼�����������ַ�Ӧ�������Ȼ��ƣ���Ӧ����ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2�������ȡ����ɡ����գ��õ�bg��������Ϊ�Ȼ��ơ����ݷ�Ӧǰ����ԭ���غ㣬������NaCl�����ʵ���Ϊxmol��̼���Ƶ����ʵ���Ϊymol����
58.5x+106y=a��x+2y=![]() �����y=
�����y=![]() mol��̼���Ƶ�����=nM=
mol��̼���Ƶ�����=nM=![]() mol��106g/mol=
mol��106g/mol=![]() g�������Ʒ��Na2CO3����������Ϊ=
g�������Ʒ��Na2CO3����������Ϊ=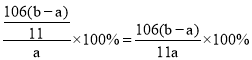 ��
��
��1���������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl��������¯�жԳ������γɵ�̼�����ƽ��и������շֽ�����̼���ơ�������̼��ˮ����ѧ����ʽ��2NaHCO3![]() Na2CO3+CO2��+H2O������ͼʾ����¯�в���������X�����ڳ����ص�ѭ��ʹ�ã�������X��CO2��
Na2CO3+CO2��+H2O������ͼʾ����¯�в���������X�����ڳ����ص�ѭ��ʹ�ã�������X��CO2��
�ʴ�Ϊ��2NaHCO3![]() Na2CO3+CO2��+H2O��CO2��
Na2CO3+CO2��+H2O��CO2��
��2��A. ��������ṩ���ܽ�ȱ������ϣ�����������NaHCO3��������Ϊһ��������NaHCO3���ܽ����С����A��ȷ��
B. �������еķ�ӦΪNaCl+CO2+NH3+H2O=NaHCO3��+NH4Cl�����˺���Һ����Ҫ���е���NH4Cl����B����
C. �����غ�����¯�з�Ӧ�õ��IJ��ﶼ����Ϊ��ȡ�����ԭ�ϣ������ѭ����Ŀ�������ԭ�ϵ������ʣ���C��ȷ��
�ʴ�ΪAC��
��3���������⣬�ɽ���Ӧ������������������������ˮ��Ӧ��������ʹ����ᣬ����ʹ���������̼������Һ��Ӧ���ɴ������ƺ�̼�����ƣ���Ӧ�Ļ�ѧ����ʽ��2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3��
�ʴ�Ϊ��2Na2CO3+Cl2+H2O=NaCl+NaClO+2NaHCO3��
��4��ag����Ʒ������������ϡ���ᣬ̼�����������ַ�Ӧ�������Ȼ��ƣ���Ӧ����ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2�������ȡ����ɡ����գ��õ�bg��������Ϊ�Ȼ��ơ����ݷ�Ӧǰ����ԭ���غ㣬������NaCl�����ʵ���Ϊxmol��̼���Ƶ����ʵ���Ϊymol����
58.5x+106y=a��x+2y=![]() �����y=
�����y=![]() mol��̼���Ƶ�����/span>=nM=
mol��̼���Ƶ�����/span>=nM=![]() mol��106g/mol=
mol��106g/mol=![]() g�������Ʒ��Na2CO3����������Ϊ=
g�������Ʒ��Na2CO3����������Ϊ=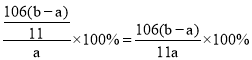 ��
��
�ʴ�Ϊ��![]() ��100%��
��100%��

����Ŀ��ijС����̽��Fe2+���ʵ�ʵ���й۲쵽�쳣����
ʵ��� | ���� |
| ��Һ��죬Ƭ�̺�ɫ��ȥ�����������ɣ�������ΪO2���� |
���ϣ�����Fe3++3SCN��=Fe(SCN)3����ɫ����Fe(SCN)3��SԪ�صĻ��ϼ�Ϊ2��
����BaSO4�Dz���������İ�ɫ����
��1��ʵ���������Fe2+��__�ԣ���ȫH2O2��FeCl2������Һ��Ӧ�����ӷ���ʽ��__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
��2��̽������ɫ��ȥ����ԭ����ʵ�����ɫ�����Һ�����ݷֱ����ʵ�顣

ʵ���ó��Ľ����ǣ���ɫ��ȥ��ԭ����__��
��3��Ϊ��һ��̽������ɫ��ȥ����ԭ������ʵ���
ʵ��� | ���� |
| ��Һ��죬һ��ʱ�����ɫ�� |
ȡ������Ӧ�����Һ���μ������BaCl2��Һ | �ް�ɫ���������� |
������������ʵ�飬����������ȷ����__������ĸ����
A��ʵ����з�����������ԭ��Ӧ��4Fe2++O2+4H+=4Fe3++2H2O
B��ͨ��ʵ����Ƴ�ʵ���������FeCl2��ֻ��O2
C��O2�ڸ�ʵ�������²���ʹ��ɫ��Һ��ɫ
D��ʵ����к�ɫ��ȥ��H2O2���������й�
��4������ʵ��̽�������õ���ʵ�鷽����__��д��һ������