题目内容
【题目】研究碘单质在相关反应中的转化和生成具有重要价值。
(1)TaS2晶体是一种强关联二维材料,在一定条件下可发生如下反应:
TaS2(s)+2I2(g) ![]() TaI4(g)+S2(g) ΔH>0
TaI4(g)+S2(g) ΔH>0
①T℃时,向体积为2 L恒容密闭容器中加入0.3 mol I2(g)和0.3 mol TaS2(s),达到平衡时,I2(g)的物质的量为0.1 mol。该反应的平衡常数为__________。向平衡后的容器中再充入0.3 mol I2(g),下列说法正确的是__________(填字母)。
A.当2v(I2)正=v(S2)逆时,反应到达新的平衡
B.当混合气体的颜色不再发生变化时,反应到达新的平衡
C.反应达到新平衡时,压强与原平衡相同
D.反应达到新平衡时,混合气体的密度是原平衡的两倍

②利用“化学蒸气转移法”可以提纯含难挥发杂质的TaS2粉末。反应在如右图所示的石英真空管中进行。先在温度为T1 的一段放入未提纯的TaS2粉末,充入少量I2(g),一段时间后,在温度为T2 一端得到了纯净TaS2晶体。则温度T1__________T2(填“>”“<”或“=” )。
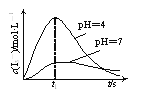
(2)某实验小组对其他条件一定,不同pH时O3持续通入NaI溶液中的过程和结果进行了研究。O3通入NaI溶液中的反应过程如下,I3-的浓度随时间的变化如下图所示。
反应1:I(aq)+O3(g)=IO(aq)+O2(g)
反应2:IO(aq)+2H+(aq)+I(aq) ![]() I2(aq)+H2O(l)
I2(aq)+H2O(l)
反应3:I2(aq)+I(aq) ![]() I3(aq)
I3(aq)
①t1 s之前,pH=4的溶液中比pH=7的溶液中I3-的浓度大的原因是__________。
②t1 s之后,溶液中I3-的浓度逐渐下降的原因是__________。
【答案】1 BD > 由反应2可知,pH越小,H+浓度越大,生成I2的反应速率快,同时反应3的速率也加快。 t1 s之后,由于反应1的持续进行,溶液中I浓度不断减小,反应3的平衡向逆反应方向移动。
【解析】
(1)①根据已知条件确定平衡时物质的浓度,代入平衡常数表达式进行计算;
A. 达到平衡时正逆反应速率相等,且各组分浓度不再发生变化;
B.当混合气体的颜色不再发生变化时,反应达到平衡状态;
C.平衡后的容器中再充入0.3 mol I2(g),增大了反应物的浓度,平衡正向移动;
D.平衡后的容器中再充入0.3 mol I2(g),达到新的平衡后气体的量是原来的2倍;
②在T2温度下,平衡正向进行,在T1温度下,平衡逆向进行;
(2)①由图象可知pH越小,c(H+)越大,反应速率越快;
②随着反应的进行I的浓度逐渐减小,平衡逆向移动;
(1)①
TaS2(s)+2I2(g) ![]() TaI4(g)+S2(g)
TaI4(g)+S2(g)

![]()
![]()
![]()
![]()
平衡常数K=![]() =
=![]() =1;
=1;
A.当v(I2)正=2v(S2)逆时,反应到达新的平衡,A项错误;;
B.当混合气体的颜色不再发生变化时,反应达到平衡状态,B项正确;
C.平衡后的容器中再充入0.3 mol I2(g),增大了反应物的浓度,平衡正向移动,生成的气体更多,因此压强与原平衡不相同,C项错误;
D.平衡后的容器中再充入0.3 mol I2(g),达到新的平衡后气体的量是原来的2倍,容器的容积不变,因此混合气体的密度是原平衡的2倍,D项正确;
②该反应为吸热反应,在T1温度下,平衡正向进行,为高温,在T2温度下,平衡逆向进行,为低温,因此T1>T2;
(2)①由图象可知pH越小,c(H+)越大,增大物质的浓度,反应速率越快,因此pH=4的溶液中比pH=7的溶液中I3-的浓度大的原因是pH越小,H+浓度越大,生成I2的反应速率快,同时反应3的速率也加快;
②随着反应的进行I的浓度逐渐减小,平衡逆向移动,因此I3-的浓度逐渐下降。

 阅读快车系列答案
阅读快车系列答案【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]
]
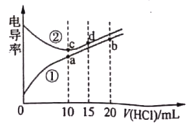
①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。