��Ŀ����
����Ŀ����ˮ��ɽ���ǽ�ɽ�yɽ��������������Ⱦ��ĺ��������Ի�������������Ҫ���塣
(1)����ijЩ�������ɹ�ʵ�ֽ������е�̼��������͵���������ת��Ϊ���Ĵ���ѭ�����ʡ�
��֪����![]()
![]()
��NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
��2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
��Ӧ![]() ��
��![]() ________
________![]() ��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քe��
��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քe��![]() ��
��![]() ��
��![]() ����÷�Ӧ��K=________(��
����÷�Ӧ��K=________(��![]() ��
��![]() ��
��![]() ��ʾ)��
��ʾ)��
(2)�¶�Ϊ![]() �慼�����ĸ��ݻ���Ϊ1L�ĺ����ܱ������з�����Ӧ��
�慼�����ĸ��ݻ���Ϊ1L�ĺ����ܱ������з�����Ӧ��
![]()
![]() ������й�ʵ���������£�
������й�ʵ���������£�
������� | ���ʵ���ʼŨ��( | ���ʵ�ƽ��Ũ��( | |
|
|
| |
�� |
|
|
|
�� |
|
| |
�� |
|
| |
�� |
|
| |
��ƽ��ʱ�������������������ѹǿ֮��___________��
���¶Ȳ��䣬�������дﵽƽ����ٳ���NO��![]() (g)��
(g)��![]() mol����Ӧ����_____________��(����������������)������С�
mol����Ӧ����_____________��(����������������)������С�
(3)��������0.100![]() ����ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100
����ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100![]() ��NaOH��Һ�Ͷ��װ�[
��NaOH��Һ�Ͷ��װ�[![]() ]
]

��a��b��c��d�ĵ��ˮ��Һ�У���ˮ�����������Ũ�ȴ���![]()
![]() ����________________��ԭ��Ϊ_____________________��
����________________��ԭ��Ϊ_____________________��
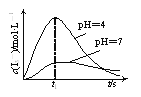
�ڻ�ѧ��Ӧ����������ЧӦ��Ϊ������ϵa���¶�______________(����>������=������<��)c����¶ȡ�
���𰸡�-234.0 K2![]() 1��1 �� a ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����� <
1��1 �� a ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����� <
��������
��1�����ݸ�˹���ɽ��м��㣻
��2����������ʽ������ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬ƽ�ⳣ�����䣬������ݽ������㣻
(3) ��NaOH����ǿ����װ���ˮ��Һ����������Һ�����ߢ�Ϊ�ζ����װ���Һ��ǿ�������Σ���ˮ�ĵ����дٽ����ã�
������кͷ�ӦΪ���ȷ�Ӧ�����װ��ĵ������ȣ���Ϊ������ϵa���¶�<c����¶ȡ�
��1����֪����![]()
![]()
��![]()
![]()
��![]()
![]()
���ݸ�˹���ɣ��ɢ�+����![]() -����
-����![]() �÷�Ӧ
�÷�Ӧ![]() ��
��![]() +
+![]() ��
��![]() -
-![]() ��
��![]() =-234.0
=-234.0![]() ���������Ϸ�Ӧ��֪��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քeΪ
���������Ϸ�Ӧ��֪��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քeΪ![]() ��
��![]() ��
��![]() ����÷�Ӧ��K=K2
����÷�Ӧ��K=K2![]() ��
��
��2�����º����£���ϵ��ѹǿ�ȵ�����������ʵ���֮�ȣ����ڷ�Ӧ���У�
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
��ʼ�� 6 2 0 0
��Ӧ�� x x 0.5x x
ƽ�⣺ 6-x 2-x 0.5x x
���ڷ�Ӧ���У�
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
��ʼ�� 2 6 0 0
��Ӧ�� y y 0.5y y
ƽ�⣺ 2-y 6-y 0.5y y �����ϵ�λ����10-3mol/L��
���¶���ͬ������Ӧ��ƽ�ⳣ����Ȼ��ȣ��г���ƽ�ⳣ������ʽK= ��һ���õ�x=y����õ���ƽ��ʱ������Ӧ��ϵ�����������ʵ�����ȣ�����ѹǿ��ȣ���ƽ��ʱ�������������������ѹǿ֮��Ϊ1��1��
��һ���õ�x=y����õ���ƽ��ʱ������Ӧ��ϵ�����������ʵ�����ȣ�����ѹǿ��ȣ���ƽ��ʱ�������������������ѹǿ֮��Ϊ1��1��
�ڶ��ڷ�Ӧ���У�
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
��ʼ�� 0.006 0.001 0 0
��Ӧ�� 0.0004 0.0004 0.0002 0.0004
ƽ�⣺ 0.0056 0.0006 0.0002 0.0004
K=![]() =2.83��
=2.83��
����III��ʼ����NO��H2��Ũ������Ϊ1��10-3mol/L��6��10-3mol/L�����ݷ���ʽ���ص㣬�¶Ȳ��䣬���������������ƽ�ⳣ����ȣ�����III�ﵽƽ��ʱNO��H2��N2��H2O��g�������ʵ���Ũ������Ϊ0.0006mol/L��0.0056mol/L��0.0002mol/L��0.0004mol/L�����Գ���NO��H2O(g����2��10-4mol����Q=![]() =3.59>K���ʷ�Ӧ�����淴Ӧ������У�
=3.59>K���ʷ�Ӧ�����淴Ӧ������У�
(3) ��NaOH����ǿ����װ���ˮ��Һ����������Һ�����ߢ�Ϊ�ζ����װ���Һ������������������ˮ�ĵ��룬����ˮ��ٽ�ˮ�ĵ��룬�ζ��յ�ǰ��������ζ��յ���������ǡ����ȫ�ζ�ʱ�γ��Σ�NaCl����ˮ�⣬��(CH3��2NH2+��ˮ�⣬����10mL����ʱǡ����ȫ��Ӧ����ˣ�a��b��c��d�ĵ����Һ�У�a����ˮ�����������Ũ�ȴ���![]()
![]() ����Ϊ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����ã�
����Ϊ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����ã�
������кͷ�ӦΪ���ȷ�Ӧ�����װ��ĵ������ȣ���Ϊ������ϵa���¶�<c����¶ȡ�

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ��� ( )
��� | A | B | C | D |
ʵ�� |
|
|
|
|
ʵ�� | ��֤�������� | ��֤Fe�缫������ | ��֤��Ȳ�Ļ�ԭ�� | ��֤�������������� |
A.AB.BC.CD.D
����Ŀ��̼��þ������һ�������������β����е���ǿ����ij������MgCl2(����������FeCl2��FeCl3)Ϊԭ���Ʊ�̼��þ���루MgCO3��H2O���Ĺ����������£�

��֪��Fe3+��Fe2+��Mg2+���������������ʱ��pH
ע��Fe(OH)2��������״�����״���Һ�г�ȥ��
���� | ��ʼ���� | ������ȫ |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.0 |
��1��д���������������з��������ӷ�Ӧ����ʽ_______________��
��2��pH���ڵķ�Χ___________����������Ҫ�ɷ�___________���ѧʽ����
��3������X�������ˡ�ϴ�ӡ���ɣ�֤��̼��þ�����Ѿ�ϴ�Ӹɾ��ķ���______________��
��4��ˮ������Һ��Fe2+��Fe3+�����IJⶨ
��ȡˮ������Һ100.00 mL�����Cl-��Ũ��Ϊ0.455 mol��L-1�������л���ͨ������ʹFe2+ǡ����ȫת��ΪFe3+����ô�ʱ��Һ��Cl-��Ũ��Ϊ0.460 mol��L-1����Һ����仯���Բ��ƣ���
����ȡˮ������Һ100.00 mL�������м��������1 mol��L-1NaOH��Һ����ַ�Ӧ����ˡ�ϴ�ӡ����գ���ȴ�Ƶù����ĩ������Ϊ0.96 g����ͨ������ȷ��ˮ������Һ��Fe2+��Fe3+�����ʵ���Ũ�ȣ�д��������̣��� _______________________