题目内容
18.废旧铅蓄电池的回收利用是发展循环经济的必经之路.其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO•PbSO4•H2O),其工艺流程如下: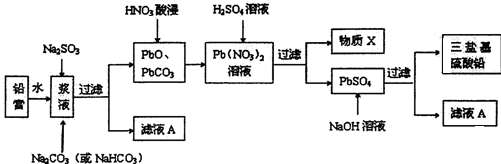
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,转化反应式如下:
PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq)
①下列说法错误的是:B.
A.PbSO4的Ksp比PbCO3的Ksp大
B.该反应平衡时,c(CO32-)=c(SO42-)
C.该反应的平衡常数K=$\frac{{K}_{SP}(PbS{O}_{4})}{{K}_{SP}(PbC{O}_{3})}$
②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在Na2CO3溶液中PbSO4转化率较大,理由是相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大.
(2)滤液A能用来回收Na2SO4•10H2O,提取该晶体的主要步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-.
(3)物质X是一种可循环使用的物质,其溶质主要是HNO3 (填化学式),若X中残留的SO42-过多,循环利用时可能出现的问题是浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)生成三盐基硫酸铅的离子方程式为4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O.
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO.若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入60mL的0.5mol•L-1 Na2SO3溶液.
分析 (1)①A.用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,说明碳酸铅的溶解度小于硫酸铅;
B.浓度不变不一定相等;
C.反应的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$,其分子和分母同乘以铅离子的浓度结合Ksp分析;
②碳酸根离子浓度越大硫酸铅的转化率越高,而碳酸钠直接电离产生碳酸根离子,而碳酸氢钠是多元弱酸的酸式盐,盐电离产生的酸根离子碳酸氢根离子微弱的电离产生碳酸根离子;
(2)溶液中得到溶质晶体的方法为蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作;该晶体的阴离子为硫酸根离子,根据检验硫酸根离子的方法解答;
(3)根据制取流程可知,利用废旧铅蓄电池阴、阳极填充物(铅膏)制备塑料加工热稳定剂三盐基硫酸铅实验流程.向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原PbO,Na2SO3+PbO2=PbO+Na2SO4,加Na2CO3溶液是将PbSO4转化成PbCO3,所以滤液Ⅰ主要是Na2SO4溶液.PbO和PbCO3在硝酸的作用下转化成Pb(NO3)•Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3;
若母液中残留的SO42-过多,浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)根据流程可知,PbSO4与氢氧根离子反应生成三盐基硫酸铅,据此写出反应的离子方程式;
(5)根据电子守恒可得关系式Na2SO3~2e-~PbO2,则n(Na2SO3)=n( PbO2),再根据V=$\frac{n}{c}$计算出需要0.5mol/L Na2SO3溶液的体积.
解答 解:(1)①A.用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,说明碳酸铅的溶解度小于硫酸铅,所以PbSO4的Ksp比PbCO3的Ksp大,故正确;
B.浓度不变不一定相等,故错误;
C.根据反应的平衡常数的表达式书写,K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$的分子和分母同乘以铅离子的浓度,即K=$\frac{{K}_{SP}(PbS{O}_{4})}{{K}_{SP}(PbC{O}_{3})}$,故正确;
故选:B;
②碳酸根离子浓度越大硫酸铅的转化率越高,而碳酸钠直接电离产生碳酸根离子,而碳酸氢钠是多元弱酸的酸式盐,盐电离产生的酸根离子碳酸氢根离子微弱的电离产生碳酸根离子,所以同浓度的两种盐,碳酸钠溶液中的碳酸根离子浓度大于碳酸氢钠溶液中碳酸根离子的浓度,
故答案为:Na2CO3;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大;
(2)回收Na2SO4•10H2O,温度不宜过高,否则容易失去结晶水,所以溶液中得到溶质晶体的方法为:蒸发浓缩,冷却结晶,过滤洗涤,干燥等;Na2SO4•10H2O中阴离子为SO42-,检验硫酸根离子的方法为:取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-,
故答案为:蒸发浓缩;冷却结晶;取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-;
(3)由流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2 ,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3,HNO3在反应流程中可循环利用;
若母液中残留的SO42-过多,浸出时部分铅离子会与SO42-反应生成PbSO4随浸出渣排出,降低了PbSO4的产率,
故答案为:HNO3 ;浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)硫酸铅在碱溶液中与氢氧根离子反应生成三盐基硫酸铅,反应的离子方程式为:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O,
故答案为:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O;
(5)向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO,若实验中所取铅膏浆液质量为47.8g,其中PbO2的质量分数为15.0%,要将PbO2还原,加入的亚硫酸钠依据化学方程式定量关系和电子守恒计算得到:Na2SO3~2e-~PbO2,
则:n(Na2SO3)=n( PbO2)=$\frac{47.8g×15%}{239g/mol}$=0.03mol,
所以需要亚硫酸钠溶液的体积为:$\frac{0.03mol}{0.5mol/L}$=0.06L=60mL,
故答案为:60.
点评 本题通过三盐基硫酸铅的制备流程,考查了物质制备方案的设计方法,题目难度中等,注意掌握物质制备方案的设计原则,正确分析制备流程得出物质的制备原理为解答此类题的关键,试题有利于提高学生的分析、理解能力及化学实验能力,试题的综合性较强,是一道质量较好的题目.

 字词句段篇系列答案
字词句段篇系列答案| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
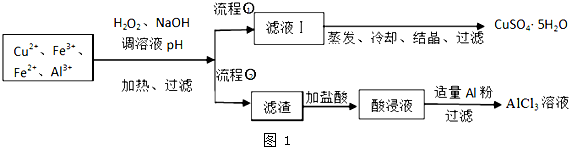
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
(1)加入H2O2的作用是将Fe2+氧化为Fe3+,欲使制取的CuSO4•5H2O晶体较为纯净,pH至少应调至5.0;
(2)写出H2O2与Fe2+离子方程式H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)流程②中加入适量Al粉起的作用是与酸浸液中Fe3+和H+反应生成Al3+;
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3不能(填:能或不能),原因是直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝;
(5)取体积为V(L)的酸浸液,向其中滴加a mol•L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图2.请用V1、V2、V3表示所取的酸浸液中n(Fe3+):n(Al3+)$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$.
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
(2)采用石墨作电极电解上述酸洗废液时,初始阶段,阳极板上有气泡生成,此时与该现象有关的阳极电极反应式为2Cl--2e-=Cl2↑;向上述酸洗废液中加入KOH溶液中和后,在合适的电压下电解,可在阳(填“阴”或“阳”)极生成高铁酸钾(K2FeO4).
(3)利用上述酸洗废液、含铝矿石(主要成分为Al2O3、Fe2O3和SiO2)以及新制的硅酸(活化硅酸),制备聚硅酸氯化铝铁絮凝剂(简称PAFSC),具体方法如图1:
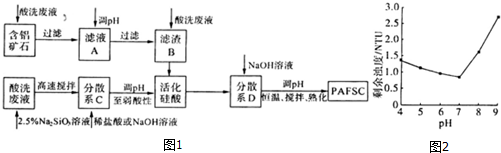
①适当调高滤液A的pH,Al3+和Fe3+转化为沉淀,原因是调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的Qc大于其Ksp;(或调高溶液pH,溶液中[OH-]增大,从而使Al(OH)3和Fe(OH)3的沉淀溶解平衡向沉淀方向移动)(请用沉淀溶解平衡的理论解释).
②PAFSC絮凝剂净化水的过程中,Al3+参与反应的离子方程式为Al3++3H2O=Al(OH)3(胶体)+3H+.
③25℃时,PAFSC的除浊效果随溶液pH的变化如图2所示(图中的NTU为浊度单位),则在下列pH范围中,PAFSC除浊效果最佳的是b(填下列序号字母).
a.4~5 b.5~7 c.7~8d.8~9
25℃时,pH>7且随pH增大,PAFSC的除浊效果明显变差,原因是碱性增强,使胶体发生了聚沉现象.
 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷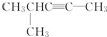 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔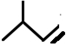
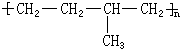 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别
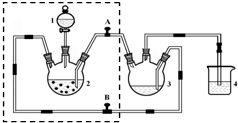 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
