题目内容
10.已知破坏1mol N≡N键、H-H键和N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.试计算1mol N2(g)和3mol H2(g)完全转化为NH3(g)的反应热的理论值,写出反应的热化学方程式.分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热并判断吸热还是放热,反应热与化学计量数成正比,结合热化学方程式的书写规则书写该反应的热化学方程式.
解答 解:拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,1mol N2(g)和3mol H2(g)完全转化为NH3(g)生成2mol NH3放出热量为92KJ,
所以该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
答:1mol N2(g)和3mol H2(g)完全转化为NH3(g)的反应热的理论值为92KJ;热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题主要考查了反应热的计算、热化学方程式的书写,注意把握从键能的角度计算反应热的方法,注意热化学方程式:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到( )
| 实验步骤 | 实验用品 | |
| A | 步骤1:将海带灼烧灰化 | 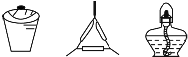 |
| B | 步骤2:将海带灰溶解、过滤 |  |
| C | 步骤3:氧化滤液中的I- |  |
| D | 步骤4:检验碘元素 |  |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
1.下列有关化学用语表示正确的是( )
| A. | 过氧化钙(CaO2)的电子式: | |
| B. | 816O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
15.下列化学用语表示正确的是( )
| A. | KF的电子式: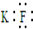 | |
| B. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| C. | 硫离子的结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
2. 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
19.某温度下,在2L密闭容器中充入一定量的N2O5,发生反应:2N2O5?4NO2+O2.反应开始时,c(N2O5)=0.04mol•L-1,30s后,c(O2)=0.01mol•L-1,则N2O5的平均反应速率为( )
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
10.某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4•5H2O晶体和AlCl3溶液:
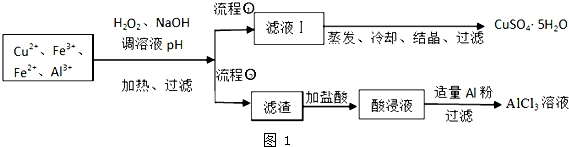
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
请回答下列问题:
(1)加入H2O2的作用是将Fe2+氧化为Fe3+,欲使制取的CuSO4•5H2O晶体较为纯净,pH至少应调至5.0;
(2)写出H2O2与Fe2+离子方程式H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)流程②中加入适量Al粉起的作用是与酸浸液中Fe3+和H+反应生成Al3+;
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3不能(填:能或不能),原因是直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝;
(5)取体积为V(L)的酸浸液,向其中滴加a mol•L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图2.请用V1、V2、V3表示所取的酸浸液中n(Fe3+):n(Al3+)$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$.


已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
(1)加入H2O2的作用是将Fe2+氧化为Fe3+,欲使制取的CuSO4•5H2O晶体较为纯净,pH至少应调至5.0;
(2)写出H2O2与Fe2+离子方程式H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)流程②中加入适量Al粉起的作用是与酸浸液中Fe3+和H+反应生成Al3+;
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3不能(填:能或不能),原因是直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝;
(5)取体积为V(L)的酸浸液,向其中滴加a mol•L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图2.请用V1、V2、V3表示所取的酸浸液中n(Fe3+):n(Al3+)$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$.

 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔
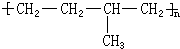 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别