题目内容
17.银锌钮扣电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为Ag2O+Zn$?_{充电}^{放电}$2Ag+ZnO,在此电池放电时,则下列说法正确的是( )| A. | 氧化银为正极,被氧化 | |
| B. | 负极发生的反应为:Zn+2OH--2e-═ZnO+H2O | |
| C. | Zn为负极,被还原 | |
| D. | 该装置中的电解质为酸性物质 |
分析 由充电和放电过程可以表示为Ag2O+Zn$?_{充电}^{放电}$2Ag+ZnO可知,放电时为原电池,负极上锌失电子发生氧化反应,正极上氧化银得电子发生还原反应,以此来解答.
解答 解:A.氧化银为正极,被还原,故A错误;
B.负极上Zn失去电子被氧化,则负极发生的反应为:Zn+2OH--2e-═ZnO+H2O,故B正确;
C.Zn为负极,失去电子被氧化,故C错误;
D.Zn及金属氧化物与酸反应,则该装置中的电解质应为碱性物质,故D错误;
故选B.
点评 本题考查原电池知识,为高考常见题型,侧重于学生的分析能力和应用能力的考查,注意把握元素的化合价变化及电极反应式的书写,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列物质中,既有离子键又有共价键的是( )
| A. | CaCl2 | B. | KOH | C. | H2O | D. | HCl |
5.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是( )
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A. | 实验①反应后的溶液中:c(HA)=c(OH-)-c(H+) | |
| B. | 实验①反应后的溶液中:c(OH-)=c(K+)+c(H+)-c(A-) | |
| C. | 实验②反应后的溶液中:c(A-)+c(HA)>0.2mol•L-1 | |
| D. | 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
12.在一定温度下,反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 单位时间内生成n molA2同时生成n mol AB3 | |
| B. | 容器内的总物质的量不随时间变化 | |
| C. | 单位时间内生成2n mol AB3的同时生成n molB2 | |
| D. | 单位时间内生成n molA2的同时生成n molB2 |
2.下列说法正确的是( )
| A. | 在实验室中将工业酒精转化为无水酒精的方法是:加入过量的生石灰后分液 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 用重结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| D. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
9.下列各组顺序的排列不正确的是( )
| A. | 金属性:Na>Mg>Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性性强弱:NaOH>Mg(OH)2>Al(OH)3 | D. | 非金属性:F>Cl>S>O |
6.下列说法中正确的是( )
| A. | 用完的电池可以随意地丢弃 | |
| B. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| C. | 实验室用一定质量的锌和过量的稀硫酸反应制取氢气时,加入少量硫酸铜可以加快反应速率且生成氢气的量不变 | |
| D. | 把煤粉碎后再燃烧可以提高煤的燃烧效率 |
7.下列有关实验的说法中错误的是( )
| A. | 石蜡油分解产物中含有烯烃 | |
| B. | 直接蒸馏含杂质的工业乙醇不能得到无水乙醇 | |
| C. | 实验室用苯和溴水在溴化铁催化作用下制取溴苯 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应制取硝基苯 |
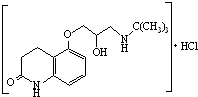 )可用于治疗心绞痛和青光眼.
)可用于治疗心绞痛和青光眼.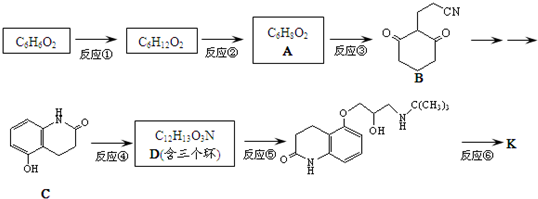
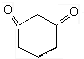 D
D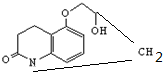
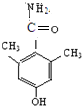 、
、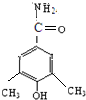
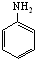 )与HNO2和H3PO2反应可得苯.请设计从C合成
)与HNO2和H3PO2反应可得苯.请设计从C合成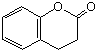 的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)