题目内容
5.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A. | 实验①反应后的溶液中:c(HA)=c(OH-)-c(H+) | |
| B. | 实验①反应后的溶液中:c(OH-)=c(K+)+c(H+)-c(A-) | |
| C. | 实验②反应后的溶液中:c(A-)+c(HA)>0.2mol•L-1 | |
| D. | 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
分析 A.实验①反应后,等体积等浓度恰好生成KA,结合质子守恒分析;
B.溶液遵循电荷守恒;
C.若x=0.2,与实验①相似,溶液显碱性,而实验②显中性,则酸应稍过量;
D.结合电荷守恒及溶液为中性分析.
解答 解:A.实验①反应后,等体积等浓度恰好生成KA,由质子守恒可知,c(HA)=c(OH-)-c(H+),故A正确;
B.实验①反应后的溶液,由电荷守恒可知:c(OH-)+c(A-)=c(K+)+c(H+),则c(OH-)=c(K+)+c(H+)-c(A-),故B正确;
C.若x=0.2,与实验①相似,溶液显碱性,而实验②显中性,则酸应稍过量,则反应后溶液中由物料守恒可知c(A-)+c(HA)>$\frac{0.2mol/L×VL}{VL+VL}$=0.1 mol/L,故C错误;
D.混合后溶液pH=7,c(OH-)=c(H+),溶液中存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(A-),所以反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+),故D正确;
故选C.
点评 本题考查了电解质溶液中离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,能够根据电荷守恒、物料守恒、质子守恒、盐的水解原理等知识判断溶液中离子浓度大小,试题充分考查了学生的分析、理解能力.

练习册系列答案
相关题目
16.常温下在稀溶液中能表示中和热的热化学方程式为( )
| A. | H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H1=aKJ•mol-1 | |
| B. | HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l)△H2=bKJ•mol-1 | |
| C. | HCl(aq)+NH3•H2O (aq)=NH4Cl(aq)+H2O(l)△H3=cKJ•mol-1 | |
| D. | H+(aq)+OH-(aq)+$\frac{1}{2}$Ba2+(aq)+$\frac{1}{2}$SO42-(aq)=$\frac{1}{2}$BaSO4(s)+H2O(l)△H4=dKJ•mol-1 |
13.质量相同的铝粉和足量的盐酸、足量的NaOH溶液完全反应,在同温同压下生成气体的体积比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 1:4 |
20.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将Na2CO3固体加入新制的氯水中,有无色气泡(H+) | |
| B. | 向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 新制氯水使红色布条褪色(HCl) |
10.下列措施对增大反应速率明显有效的是( )
| A. | Al在氧气中燃烧生成Al2O3,将Al粉改为Al片 | |
| B. | Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末 | |
| C. | Na与水反应时增大钠的用量 | |
| D. | 灼热的碳与水蒸气反应时,向体系中通入水蒸气 |
17.银锌钮扣电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为Ag2O+Zn$?_{充电}^{放电}$2Ag+ZnO,在此电池放电时,则下列说法正确的是( )
| A. | 氧化银为正极,被氧化 | |
| B. | 负极发生的反应为:Zn+2OH--2e-═ZnO+H2O | |
| C. | Zn为负极,被还原 | |
| D. | 该装置中的电解质为酸性物质 |
14.现有部分短周期元素的性质或原子结构如表:下列叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | M层上的电子数为6个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7 |
| A. | 元素X的一种同位素可测定文物年代,这种同位素的符号是12C | |
| B. | 元素Z的非金属性比元素T弱 | |
| C. | Y和T位于同一主族 | |
| D. | T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸 |


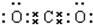
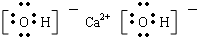


 .
.