题目内容
15.下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是( )| A. | Na+、NO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、SO${\;}_{4}^{2-}$ | B. | Na+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | Na+、Mg2+、Cl-、HCO${\;}_{3}^{-}$ |
分析 A.四种离子之间不反应,但加入盐酸后不会生成气体;
B.铝离子能够与碱性溶液中的氢氧根离子反应,且加入盐酸后不会生成气体;
C.四种离子之间不反应,都不与碱性溶液反应,加入盐酸后生成二氧化碳气体、氢氧化铝沉淀;
D.镁离子、碳酸氢根离子与氢氧根离子反应,且加入盐酸后不会生成沉淀.
解答 解:A.Na+、SO42-、NO3-、AlO2-之间不反应,但加入盐酸过程中不会生成气体,故A错误;
B.Na+、SO42-、NO3-、Al3+之间,但Al3+与碱性溶液反应,且加入盐酸后不会生成气体和沉淀,故B错误;
C.K+、Cl-、CO32-、AlO2-之间不反应,都不与强碱性溶液反应,加入盐酸的过程中有氢氧化铝沉淀、二氧化碳气体生成,满足条件,故C正确;
D.Mg2+、HCO3-都与强碱性溶液反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
3.某有机物是药物生产的中间体,其结构简式如图.下列有关叙述不正确的是( )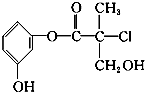

| A. | 该有机物的分子式为C10H11O4Cl | |
| B. | 该有机物与浓溴水可发生取代反应,且与浓硫酸混合共热可发生消去反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| D. | 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
10.下面有关铜的化合物的性质叙述中正确的是( )
| A. | CuSO4变成CuSO4•5H2O是物理变化 | |
| B. | 一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应 | |
| C. | CuO是黑色固体,与水反应可生成Cu(OH)2 | |
| D. | Cu2O遇硝酸可能会被氧化成Cu2+ |
20.黑火药爆炸过程中发生反应的化学方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑.下列说法正确的是( )
| A. | 每生成55 g K2S转移电子数为6.02×1023 | |
| B. | S和KNO3均为还原剂 | |
| C. | 反应过程中氮元素被还原 | |
| D. | CO2为还原产物 |
7.有关元素的以下内容,随着原子序数的递增,不呈现周期性变化的是( )
| A. | 化合价 | B. | 原子半径 | C. | 最外层电子排布 | D. | 相对原子质量 |
12.如图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
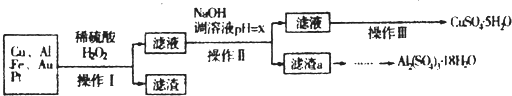
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式(Cu+H2O2+H2SO4=CuSO4+2H2O..
(2)在操作II中,x的取值范围是[5.2,5.4).
(3)在操作III中,蒸发浓缩需要的玻璃仪器有玻璃棒、酒精灯、烧杯.
(4)由滤渣a制取Al2(SO4)3.18H2O,探究小组设计了三种方案:
甲:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
乙:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$过滤$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
丙:滤渣a$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4.5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol.L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4.5H2O晶体的纯度是$\frac{15b}{a}$×100%.

已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式(Cu+H2O2+H2SO4=CuSO4+2H2O..
(2)在操作II中,x的取值范围是[5.2,5.4).
(3)在操作III中,蒸发浓缩需要的玻璃仪器有玻璃棒、酒精灯、烧杯.
(4)由滤渣a制取Al2(SO4)3.18H2O,探究小组设计了三种方案:
甲:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
乙:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$过滤$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
丙:滤渣a$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4.5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol.L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4.5H2O晶体的纯度是$\frac{15b}{a}$×100%.