题目内容
10.下面有关铜的化合物的性质叙述中正确的是( )| A. | CuSO4变成CuSO4•5H2O是物理变化 | |
| B. | 一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应 | |
| C. | CuO是黑色固体,与水反应可生成Cu(OH)2 | |
| D. | Cu2O遇硝酸可能会被氧化成Cu2+ |
分析 A、硫酸铜和水发生反应生成硫酸铜晶体;
B、氢氧化铜和乙酸发生酸碱中和反应;
C、氧化铜不与水发生反应;
D、Cu2O遇酸溶液中发生自身氧化还原反应;
解答 解:A、硫酸铜和水发生反应生成硫酸铜结晶水合物,属于化学变化,故A错误;
B、氢氧化铜和乙酸发生酸碱中和反应,沉淀溶解,故B错误;
C、氧化铜难溶于水,不与水发生反应生成氢氧化铜,故C错误;
D、Cu2O遇酸溶液中发生自身氧化还原反应生成铜和铜离子,Cu2O+2H+═Cu2++Cu+H2O,故D正确;
故选D.D
点评 本题考查了铜及其化合物性质分析判断,掌握基础是关键,注意氧化还原反应的分析理解,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.一定温度下2L的密闭容器中发生反应:A(g)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如图所示.下列有关说法不正确的是( )
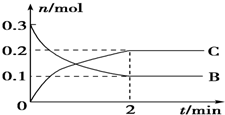

| A. | X=2 | |
| B. | 反应开始2min内,v(C)=0.05 mol•L-1•min-1 | |
| C. | 2min后,升高温度平衡向右移动 | |
| D. | 当容器内混合气体压强不再改变时,反应体系达到化学平衡状态 |
1.下列不能表明醋酸是弱电解质的是( )
| A. | 0.1mol/L的醋酸水溶液的pH值为3 | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使石蕊变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
18.下列说法正确的是( )
| A. | 氯水、氨水和食盐水都能导电,所以Cl2、NH3和NaCl都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向右移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
5.下列有机反应中,有一种反应类型与其他三种反应类型不同的是( )
| A. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 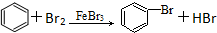 |
15.下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是( )
| A. | Na+、NO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$、SO${\;}_{4}^{2-}$ | B. | Na+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | Na+、Mg2+、Cl-、HCO${\;}_{3}^{-}$ |
2.下列实验操作中正确的是( )
| A. | 蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏石油时,应使温度计水银球插入液面以下 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口放到另一个烧杯 | |
| D. | 检验硫酸根离子的操作是先加硝酸酸化再加入氯化钡溶液 |
19.2molNaOH配成200mL溶液,其物质的量浓度为( )
| A. | 2mol/L | B. | 10 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |