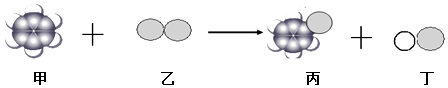
��Ŀ����
����Ŀ������������м��㣺
��1��ʵ����16g�״�[CH3OH��l��]�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�363.25kJ����������д���״�ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��2���ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̣���֪��Ӧ��N2��g��+3H2��g��2NH3��g����H=a kJmol��1 �� �йؼ������������
��ѧ�� | H��H | N��H | N��N |
���ܣ�kJmol��1�� | 436 | 391 | 945 |
�Ը��ݱ������м������ݹ���a����ֵ ��
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ�ķ�Ӧ�Ƚ������㣮��֪��
C��s��ʯī��+O2��g���TCO2��g����H1=��393.5kJmol��1
2H2��g��+O2��g���T2H2O��l����H2=��571.6kJmol��1
2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H3=��2599kJmol��1
���ݸ�˹���ɣ�����298Kʱ��C��s��ʯī����H2��g������1mol C2H2��g����Ӧ�ķ�Ӧ��Ϊ����H= ��
��4�����������õ������£�NH4+����������Ӧ��������NO3�� �� ������Ӧ�������仯ʾ
��ͼ��ͼ��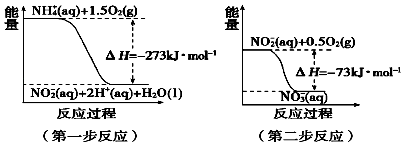
��һ����Ӧ����Ӧ������ȡ������ȡ�����ԭ���� ��
���𰸡�
��1��CH3OH ��l��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��726.5KJ/mol
O2��g��=CO2��g��+2H2O��l����H=��726.5KJ/mol
��2����93
��3��+226.7 KJ/mol
��4������,��Ӧ������������������������
���������⣺��1��16gCH3OH��������ȼ������CO2��Һ̬ˮ���ų�363.25kJ������32g��1molCH3OH��������ȼ������CO2��Һ̬ˮ���ų�726.5kJ���������H=��726.5KJ/mol����ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH3OH ��l��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��726.5KJ/mol��
O2��g��=CO2��g��+2H2O��l����H=��726.5KJ/mol��
���Դ��ǣ�CH3OH ��l��+ ![]() O2��g��=CO2��g��+2H2O��l����H=��726.5KJ/mol��
O2��g��=CO2��g��+2H2O��l����H=��726.5KJ/mol��
��2��N2��g��+3H2��g��2NH3��g����H=945kJmol��1+436kJmol��1��3��391kJmol��1��6=��93kJmol��1=a kJmol��1�����a=��93��
���Դ��ǣ���93��
��3����֪����C ��s��ʯī��+O2��g��=CO2��g����H1=��393.5kJmol��1��
��2H2��g��+O2��g��=2H2O ��l����H2=��571.6kJmol��1��
��2C2H2��g��+5O2��g���T4CO2��g��+2H2O ��l����H2=��2599kJmol��1��
2C ��s��ʯī��+H2��g��=C2H2��g���ķ�Ӧ���Ը��ݢ١�2+�ڡ� ![]() ���ۡ�
���ۡ� ![]() �õ���
�õ���
���Է�Ӧ�ʱ��H=2������393.5kJmol��1��+����571.6kJmol��1���� ![]() ������2599kJmol��1����
������2599kJmol��1���� ![]() =+226.7kJmol��1��
=+226.7kJmol��1��
���Դ��ǣ�+226.7 KJ/mol��
��4����Ϊ��H=��273kJ/mol��0����ӦΪ���ȷ�Ӧ����Ӧ����������������������������
���Դ��ǣ����ȣ���Ӧ��������������������������
�����㾫�������ڱ��⿼��ķ�Ӧ�Ⱥ��ʱ䣬��Ҫ�˽��ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ��ܵó���ȷ�𰸣�