��Ŀ����
����Ŀ���������Һ��������Խǿ���絼��Խ��������0.1000 mol/L ����ֱ�ζ�10.00 mLŨ�Ⱦ�Ϊ0.1000 mol/L��NaOH��Һ�Ͷ��װ�[ (CH3)2NH]��Һ( ���װ���ˮ�е����백���ƣ���֪�ڳ�����Kb[(CH3)2NH��H2O] =1.6��10-4)�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����
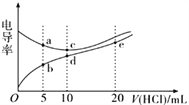
A. ����ζ����װ�ʵ����ѡ���̪��ָʾ����ѡ��������С
B. d����Һ�У�c(H+)<c(OH-)+c[(CH3)2NH2+]
C. a ����Һ��d�����Һ��Ϻ����Һ�У�c[(CH3)2NH2+]<c[(CH3)2NH��H2O]
D. b��c��e.�������Һ�У�ˮ�ĵ���̶�������e��
���𰸡�B
������������ͼ�����Ϸ�������Ϊ�����·�����Ϊ�٣���������ǰ��Ũ�Ⱦ�Ϊ![]() ��
��![]() �Ͷ��װ�[
�Ͷ��װ�[![]() ]��Һ��
]��Һ��![]() ��ǿ���ȫ���룬��Һ����������ǿ���������������ζ�
��ǿ���ȫ���룬��Һ����������ǿ���������������ζ�![]() ��Һ�����ߣ������������ζ�
��Һ�����ߣ������������ζ�![]() ��Һ�����ߡ�����ζ����װ�������ҺΪǿ������������Һˮ�������������ȵı�ɫ��ΧΪpH:3.1~4.4֮������̪�ı�ɫ��Χ��pH:8.2~10֮�䣬���ʹ�ü�������С��A������d����Һ��,����Ϊ
��Һ�����ߡ�����ζ����װ�������ҺΪǿ������������Һˮ�������������ȵı�ɫ��ΧΪpH:3.1~4.4֮������̪�ı�ɫ��Χ��pH:8.2~10֮�䣬���ʹ�ü�������С��A������d����Һ��,����Ϊ![]() ,
,![]() ,d����Һ��,���������غ�,��:
,d����Һ��,���������غ�,��:![]() ,������c(H+)<c(OH-)+c[(CH3)2NH2+]��B��ȷ��a ����Һ��ҺΪ�������ƺ��Ȼ��ƻ��Һ����Ϊ0.0005mol��, d�����ҺΪ
,������c(H+)<c(OH-)+c[(CH3)2NH2+]��B��ȷ��a ����Һ��ҺΪ�������ƺ��Ȼ��ƻ��Һ����Ϊ0.0005mol��, d�����ҺΪ![]() ,����Ϊ0.001 mol������Һ��Ϻ����ʱ�Ϊ
,����Ϊ0.001 mol������Һ��Ϻ����ʱ�Ϊ![]() ���Ȼ��ƵĻ��Һ����Һ�����ԣ�����c[(CH3)2NH2+]>c[(CH3)2NH��H2O]��C�������ɷ�������֪��,������Ϊ
���Ȼ��ƵĻ��Һ����Һ�����ԣ�����c[(CH3)2NH2+]>c[(CH3)2NH��H2O]��C�������ɷ�������֪��,������Ϊ![]() �ı仯����,b����Һ������Ϊ
�ı仯����,b����Һ������Ϊ![]() ��
��![]() ,
,![]() �������������������ˮ�ĵ���,c������ΪNaCl��ˮ�ĵ�����Ӱ��,d��Ϊ
�������������������ˮ�ĵ���,c������ΪNaCl��ˮ�ĵ�����Ӱ��,d��Ϊ![]() ,ˮ��ٽ�ˮ�ĵ���,��Һe�����Һ������Ϊ
,ˮ��ٽ�ˮ�ĵ���,��Һe�����Һ������Ϊ![]() ��HCl,HCl����ˮ�ĵ���,����b��c��e.�������Һ�У�ˮ�ĵ���̶�������c�㣻D��������ȷѡ��B��
��HCl,HCl����ˮ�ĵ���,����b��c��e.�������Һ�У�ˮ�ĵ���̶�������c�㣻D��������ȷѡ��B��

����Ŀ������������м��㣺
��1��ʵ����16g�״�[CH3OH��l��]�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�363.25kJ����������д���״�ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��2���ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̣���֪��Ӧ��N2��g��+3H2��g��2NH3��g����H=a kJmol��1 �� �йؼ������������
��ѧ�� | H��H | N��H | N��N |
���ܣ�kJmol��1�� | 436 | 391 | 945 |
�Ը��ݱ������м������ݹ���a����ֵ ��
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ�ķ�Ӧ�Ƚ������㣮��֪��
C��s��ʯī��+O2��g���TCO2��g����H1=��393.5kJmol��1
2H2��g��+O2��g���T2H2O��l����H2=��571.6kJmol��1
2C2H2��g��+5O2��g���T4CO2��g��+2H2O��l����H3=��2599kJmol��1
���ݸ�˹���ɣ�����298Kʱ��C��s��ʯī����H2��g������1mol C2H2��g����Ӧ�ķ�Ӧ��Ϊ����H= ��
��4�����������õ������£�NH4+����������Ӧ��������NO3�� �� ������Ӧ�������仯ʾ
��ͼ��ͼ��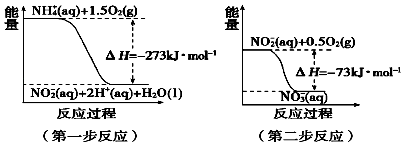
��һ����Ӧ����Ӧ������ȡ������ȡ�����ԭ���� ��