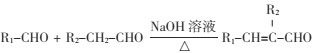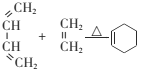题目内容
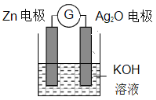
【题目】如下图所示装置图,下列叙述不正确的是
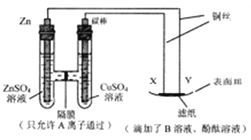
A. X与滤纸接触处的铜丝发生反应Cu-2e-=Cu2+
B. 碳棒表面逐渐生成红色物质
C. 若隔膜左侧溶液中始终只有一种溶质,则A离子不能是Cu2+
D. 若滤纸与Y接触处变红,则B溶液可以是AgNO3溶液
【答案】D
【解析】根据图示,左侧为原电池,Zn为负极、C棒为正极;右侧为电解池,X是阳极、Y是阴极;X是阳极,阳极反应是Cu-2e-=Cu2+,故A正确;碳棒是原电池正极,电极反应为Cu2++2e-=Cu,碳棒表面逐渐生成红色物质铜,故B正确;Zn为负极,电极反应是Zn-2e-=Zn2+,若隔膜左侧溶液中始终只有一种溶质,则A离子是Zn2+,故C正确;若B溶液是AgNO3溶液,Y电极反应是Ag++e-=Ag,故D错误;

【题目】根据问题进行计算:
(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式: .
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 有关键能数据如表:
化学键 | H﹣H | N﹣H | N≡N |
键能(kJmol﹣1) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值 .
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g)△H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H= .
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3﹣ . 两步反应的能量变化示
意图如图: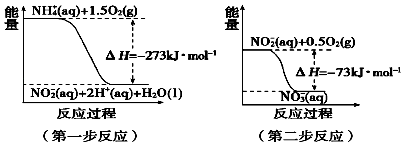
第一步反应是反应(填“放热”或“吸热”),原因是 .