题目内容
【题目】化学与生活、生产密切相关。下列叙述正确的是
A. 酯在碱性条件下的水解反应叫皂化反应![]()
B. 橡胶、合成塑料、合成纤维均是人工合成的高分子材料
C. 古代四大发明中“黑火药”的成分是“一硫二硝三木炭”,这里的“硝”指的足硝酸
D. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐
【答案】D
【解析】高级脂肪酸甘油酯在碱性条件下发生的水解反应生成噶几脂肪钠才称为皂化反应,A错误;合成橡胶、合成塑料、合成纤维均是人工合成的高分子材料,B错误;古代四大发明中“黑火药”的成分是“一硫二硝三木炭”,这里的“硝”指的是硝酸钾,C错误;“瓦”属于传统无机非金属材料,主要成分为硅酸盐,D正确; 正确选项D。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】根据问题进行计算:
(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式: .
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1 . 有关键能数据如表:
化学键 | H﹣H | N﹣H | N≡N |
键能(kJmol﹣1) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值 .
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g)△H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l)△H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H= .
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3﹣ . 两步反应的能量变化示
意图如图: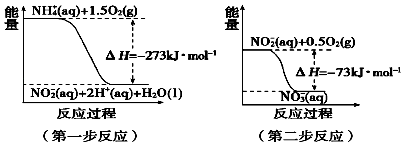
第一步反应是反应(填“放热”或“吸热”),原因是 .