��Ŀ����
����Ŀ������һ���۵�ߡ�Ӳ�ȴ����ԵĽ������㷺Ӧ���ڸ��������պ��졢��Դ������������Ŀǰ��ҵ��ʹ��һ���¹��գ��Ա��ұ�����Ĺ������һ��������ȡ��������������Ҫ����Fe2O3��Al2O3��V2O5��CuO�����幤������ͼ����:
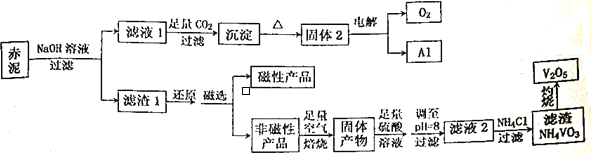
��֪:���ж��ּ�̬������+5�����ȶ���������Һ����Ҫ��VO2+��VO3-����ʽ���ڣ��Ҵ���ƽ��VO2++H2O![]() VO3-+2H+���ش���������:
VO3-+2H+���ش���������:
(1)���Բ�Ʒ�Ļ�ѧʽΪ_________________________��
(2)�������NaOH��Һ�����������ӷ�Ӧ����ʽΪ___________________���ܷ��ð�ˮ����NaOH��Һ��___________(��ܡ����ܡ�)��������___________________________________________��
(3)��Һ1���ɳ��������ӷ�Ӧ����ʽΪ_________________________________________��
(4)����pH=8��Ŀ����������һ��___________________������ʹVO2+ת��ΪVO3-����ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b��VO2++H2O![]() VO3-+2H+��ƽ�ⳣ��K=____________________��
VO3-+2H+��ƽ�ⳣ��K=____________________��
(5)��Һ2���Ȼ������NH4VO3�����ӷ���ʽΪ__________________________���÷�Ӧ�ܷ�������Ϊ__________________________________________��
���𰸡� Fe3O4 Al2O3+2OH==2A1O2+H2O ���� Al2O3�����ڰ�ˮ AlO2-+CO2+2H2O==Al(OH)3��+HCO3- ��ȥͭ����(�����Ȱ��������÷�) (b��10-16)/a VO3+NH4+=NH4VO3�� NH4VO3����
��������(1)������������������������ѧʽΪFe3O4 ����ȷ�𰸣�Fe3O4��
(2)����Ʒ�з�����֪��������Ҫ����Fe2O3��Al2O3��V2O5��CuO����������ǿ����Һ��Ӧ��ֻ������������Ӧ����ƫ�����ƺ�ˮ�����ӷ�Ӧ����ʽΪ��Al2O3+2OH-=2A1O-2+H2O��������ֻ����ǿ����ǿ�Ӧ���������Ӧ�����Բ����ð�ˮ����NaOH��Һ����ȷ�𰸣�Al2O3+2OH==2A1O2+H2O �� ���� ��Al2O3�����ڰ�ˮ��
(3) ��Һ1Ϊƫ��������Һ��ͨ�������Ķ�����̼��������������������̼�����������ӷ�Ӧ����ʽΪ��AlO2-+CO2+2H2O==Al(OH)3��+HCO3-����ȷ����AlO2-+CO2+2H2O==Al(OH)3��+HCO3-��
(4) ������Ҫ����Fe2O3��Al2O3��V2O5��CuO��������ܽ����������Ϊƫ�����ν�����Һ6�У�����������ԭΪ������ȥ������ͭ��ԭΪͭ�����������Ϊ����ͭ��Һ��������Һ��pH=8��ʹ��Һ�е�ͭ���ӱ�Ϊ��������ȥ������ƽ��VO2++H2O![]() VO3-+2H+����Һ��Ϊ���Ժ��к��������ӣ�ƽ�����ƣ�ʹVO2+ת��ΪVO3-����Һ��pH=8��c(OH-)=10-6mol/L, c(H+)=10-8 mol/L, ��ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b K=c(H+)2��c(VO3-)/ c( VO2+)=10-16��b/a������VO2++H2O
VO3-+2H+����Һ��Ϊ���Ժ��к��������ӣ�ƽ�����ƣ�ʹVO2+ת��ΪVO3-����Һ��pH=8��c(OH-)=10-6mol/L, c(H+)=10-8 mol/L, ��ʱ��Һ��VO2+��VO3-�����ʵ���֮��Ϊa:b K=c(H+)2��c(VO3-)/ c( VO2+)=10-16��b/a������VO2++H2O![]() VO3-+2H+��ƽ�ⳣ��K=(b��10-16)/a ����ȷ����(b��10-16)/a ��
VO3-+2H+��ƽ�ⳣ��K=(b��10-16)/a ����ȷ����(b��10-16)/a ��
(5)��Һ2�к���VO-3�����Ȼ�立�Ӧ�����ܽ��С��NH4VO3�����ӷ���ʽΪVO-3+NH4+=NH4VO3�����÷�Ӧ�ܷ�������ΪNH4VO3���ܣ���ȷ�𰸣�VO-3+NH4+=NH4VO3����NH4VO3���ܡ�

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д� �߽�������ϵ�д�
�߽�������ϵ�д�����Ŀ��������ʵ��װ�ý�����Ӧʵ��ܴﵽʵ��Ŀ�ĵ���
ѡ�� | A | B | C | D |
ʵ��װ�� |
|
|
|
|
ʵ��Ŀ�� | ��ɡ���Ȫ��ʵ�� | �ⶨ�к��� | ��ȡ���ռ����﴿����NH3 | ��ȡNO |
A. A B. B C. C D. D