题目内容
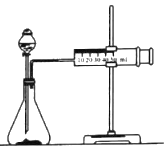
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。某学生为了探究镁条与盐酸反应过程中反应速率的变化,利用如图装置测定一定时间内反应放出氢气的体积(加入稀盐酸的体积为100mL.忽略反应中溶液体积的变化),实验记录如下表(累计值):
时间(min) | l | 2 | 3 | 4 | 5 | 6 |
氢气体积(mL)(标准状况) | 1 | 50 | 120 | 232 | 288 | 310 |
(1)除如图所示的实验用品外,还需要的一件实验仪器是_________。
(2)实验前,检查该装置气密性的方法是_________。
(3)装置气密性良好,0~lmin时间段氢气体积却很少的原因是_________。
(4)反应速率最大的时间段是_________min(填“0~1”1~2”2~3”3~4”“4~5”或“5~6”),原因是_________(从影响反应速率因素的角度解释)。
(5)3~4min时间段,以盐酸的浓度变化来表示的该反应速率为_________(设溶液体积不变)。
(6)由于反应太快,测量氢气体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列液体以减慢反应速率,你认为不可行的是_________(填相应字母)。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
【答案】 秒表或计时器等 关闭分液漏斗的活塞,将注射器活塞向外拉出一段,松开手后若活塞又回到原位,则装置气密性良好 未用砂纸打磨镁条,盐酸先与镁条表面氧化镁反应,没有氢气生成 3~4min 该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快 0. 025mol/(L·min) CD
【解析】(1)从实验装置可知,本实验是通过测量在一个时间段内所收集到的气体的体积来测定反应速率,所以先要检查装置的气密性,实验仪器还需要秒表;(2)形成压强差,将注射器活塞向外拉出一段,松开手后看活塞能否回到原位。(3)开始没有气体生成,可能是镁表面有氧化物。(4)化学反应速率=△C/△t,因为时间相同,只要气体体积差大的反应速率就大;(5)利用化学反应速率=△C/△t计算;(6)能使反应物浓度降低,就能降低反应速度,但不能改变反应的本质。
(1)从实验装置可知,本实验是通过测量在一个时间段内所收集到的气体的体积来测定反应速率,所以先要检查装置的气密性,实验仪器还需要秒表,(2)实验前,检查该装置气密性的方法是关闭分液漏斗的活塞,将注射器活塞向外拉出一段,松开手后若活塞又回到原位,则装置气密性良好;(3)装置气密性良好,0~lmin时间段氢气体积却很少的原因是未用砂纸打磨镁条,盐酸先与镁条表面氧化镁反应,没有氢气生成;(4)反应速率最大的时间段是 3~4min ,原因是该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快。(5)3~4min时间段,以盐酸的浓度变化来表示的该反应速率为:先求氢气的物质的量(288mL-232mL)/22400mL·mol-1=0.0025mol,化学反应速率=△C/△t=![]() = 0. 025mol/(L·min);(6)A.蒸馏水稀释溶液,故A正确; B.KCl溶液稀释溶液,故B正确; C.KNO3溶液,酸性条件下,硝酸与镁反应生成NO,故C错误;D.CuSO4溶液与镁反应生成铜,镁、铜和盐酸形成原电池,加快反应速率,故D错误;故选CD。
= 0. 025mol/(L·min);(6)A.蒸馏水稀释溶液,故A正确; B.KCl溶液稀释溶液,故B正确; C.KNO3溶液,酸性条件下,硝酸与镁反应生成NO,故C错误;D.CuSO4溶液与镁反应生成铜,镁、铜和盐酸形成原电池,加快反应速率,故D错误;故选CD。

 阅读快车系列答案
阅读快车系列答案【题目】根据问题填空:
(1)25℃时,在0.1L 0.2molL﹣1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH= .
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42﹣)= .
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是 .
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×l0﹣7、K2=5.6×10﹣11 |
回答下列问题
25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 .
向NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为: .
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 .



