题目内容
10.中学常见的某反应的化学方程式为A+B-→C+D+H2O(未配平,反应条件略去).请回答下列有关问题:(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中.则A与B反应的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O.
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)若C是无色刺激性气味的气体,其水溶液呈弱碱性,C能发生催化氧化反应.写出该反应的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)若D为氯碱工业的主要原料,C是造成温室效应的主要气体之一,则上述反应的化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑或NaHCO3+HCl═NaCl+H2O+CO2↑29.
分析 (1)硝酸可以将金属铁氧化到最高价,稀硝酸对应的还原产物是NO;
(2)能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫;
(3)水溶液呈弱碱性的无色刺激性气味的气体是氨气;
(4)碳酸钠、碳酸氢钠均可以和盐酸反应生成二氧化碳和水.
解答 解:(1)硝酸可以将金属铁氧化到最高价,稀硝酸对应的还原产物是NO,金属铁可以和硝酸铁反应生成硝酸亚铁,金属铁和过量的硝酸反应的方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O;
(2)能使澄清石灰水变浑浊的气体有二氧化碳、二氧化硫,单质碳可以和浓硫酸反应生成二氧化碳和二氧化硫,即C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)实验室中用氯化铵和氢氧化钙固体反应获得氨气,原理方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CaCl+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CaCl+2NH3↑+2H2O;
(4)氯化钠为氯碱工业的主要原料,二氧化碳是造成温室效应的主要气体之一碳酸钠、碳酸氢钠均可以和盐酸反应生成二氧化碳和水,
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑或NaHCO3+HCl═NaCl+H2O+CO2↑.
点评 本题是一道关于元素以及化合物之间的性质和转化知识的考题,综合性较强,难度大.

 名校课堂系列答案
名校课堂系列答案| A. | 无沉淀生成,溶液显红色 | B. | 无沉淀生成,溶液显无色 | ||
| C. | 有沉淀生成,溶液显无色 | D. | 有沉淀生成,溶液显红色 |
| A. | 羟基的电子式: | B. | 丙烷的球棍模型为: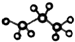 | ||
| C. |  和 和 互为同系物 互为同系物 | D. | 邻羟基苯甲酸的结构简式: |
 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中与每个K+距离最近的K+有6个 |
| A. | 用反应物A表示该反应的反应速率为0.6 mol•L-1•min-1 | |
| B. | 用反应物B表示该反应的反应速率为2.4 mol•L-1•min-1 | |
| C. | 2v(B)=3v(C) | |
| D. | 用生成物C表示该反应的反应速率为3.6 mol•L-1•min-1 |
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
| A. | 在0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>C(CO32-)>c(H2CO3) | |
| B. | 在0.1mol/LNa2CO3溶液中:c(OH-)-c(H+)=c(HC03-)+c(H2CO3) | |
| C. | 向0.2mol/LNaHCO3溶液中加入等体积0.1mol/LNaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol/L]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
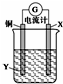
| A. | X可以是银或石墨 | B. | 电子从铜电极经外电路流向X电极 | ||
| C. | Y是硫酸铜溶液 | D. | X极上的电极反应式为Ag++e-═Ag |