题目内容
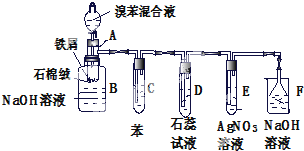
17.用1L 0.5mol/L的该NaOH溶液和足量Cl2反应,反应方程式如下:3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O.若反应完全,则消耗标准状况下Cl2的体积为5.6L;转移的电子数目为0.42mol;氧化剂和还原剂的质量比为5:1.
分析 3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,只有Cl元素的化合价变化,Cl元素的化合价由0降低为-1价,由0升高为+5价,以此来解答.
解答 解:根据3Cl2+6NaOH═5NaCl+NaClO3+3H2O,当1L 0.5mol/L的该NaOH溶液反应完全,则消耗标准状况下Cl2的体积为1×0.5×$\frac{3}{6}$×22.4=5.6L;Cl元素的化合价由0降低为-1价,由0升高为+5价,则每生成1mol的NaClO3转移5mol的电子,所转移的电子数目为1×0.5×$\frac{1}{6}$×5=0.42mol;化合价降低被还原的Cl原子即氧化剂比化合价升高被氧化的Cl原子即还原剂为5:1,故答案为:5.6;0.42mol;5:1.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
7.除去下列物质中所含的杂质(括号内为杂质),选用试剂正确的是( )
| A. | FeCl2溶液(FeCl3):Fe粉 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | Al2O3(SiO2):NaOH溶液 | D. | NaHCO3溶液(Na2CO3):Ca(OH)2溶液 |
2.下列实验实验操作或事故处理方法正确的是( )
| A. | 在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度,最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声 | |
| B. | 进行蒸馏操作时,冷凝管中的冷凝水应从上口进,下口出 | |
| C. | 萃取操作时,振荡过程中需要放气,通过旋转分液漏斗的上口的玻璃活塞进行 | |
| D. | 将饱和FeCl3溶液滴入沸水中,继续加热煮沸,并用玻璃棒不断搅拌直至体系呈红褐色即得Fe(OH)3胶体 |
在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=-92. 4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3的浓度( mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.2p1=2p3<p2 B.α2+α3<1
C.达到平衡时乙容器中NH3的体积分数最大 D.Q3+Q1>92.4
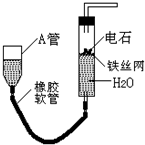 如图的实验装置可用于实验室中制取乙炔.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔.请回答下列问题: