题目内容
12.卤族元素包括F、Cl、Br、I(填元素符号),随核电荷数递增,它们的原子半径依次增大,单质的氧化性依次减弱.分析 卤族元素包括F、Cl、Br、I四种元素,随着核电荷数递增,电子层数逐渐增多,据此分析原子半径的变化;最外层电子数相同,而电子层数逐渐增多,故最外层电子离核越来越远,据此分析元素的非金属性和单质的氧化性的变化规律.
解答 解:卤族元素包括F、Cl、Br、I四种元素,随着核电荷数递增,电子层数逐渐增多,故原子半径逐渐增大;从F到I,最外层电子数相同,而电子层数逐渐增多,故最外层电子离核越来越远,收到的束缚力越来越小,故失电子越来越容易,得电子越来越难,故元素的金属性逐渐增强,非金属性逐渐减弱,则单质的还原性逐渐增强,氧化性逐渐减弱,故答案为:F、Cl、Br、I;增大;减弱.
点评 本题考查元素周期律的应用,明确同一主族元素原子结构、性质递变规律即可解答,熟练掌握元素周期律知识并灵活运用,题目难度不大.

练习册系列答案
相关题目
2.下列离子检验的正确的是( )
| A. | 某酸性溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中一定有SO42- | |
| B. | 某酸性溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中一定有Cl- | |
| C. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中有一定有CO32- | |
| D. | 某溶液中滴入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中一定有Cu2+ |
3.下列关于物质分类的说法正确的是( )
| A. | 牛奶、有色玻璃都属于胶体 | |
| B. | 漂白粉、石英都属于纯净物 | |
| C. | 氯化铵、次氯酸都属于强电解质 | |
| D. | 葡萄糖、蛋白质都属于高分子化合物 |
20.工业上获得苯的主要途径是( )
| A. | 煤的干馏 | B. | 石油的常压分馏 | ||
| C. | 石油的催化裂化 | D. | 以环己烷为原料脱氢 |
下列实验操作、现象与结论对应关系正确的是
选项 | 操作 | 现象 | 结论 |
A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液 | 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油,放入无水乙醇中 | 产生气泡 | Na能置换出醇烃基中的氢 |
C | 将某气体通入品红溶液 | 溶液褪色 | 气体一定是SO2 |
D | 向NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-结合H+的能力比HCO3-强 |
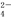 =BaSO4↓
=BaSO4↓ =CaCO3↓+CO
=CaCO3↓+CO +2H2O
+2H2O