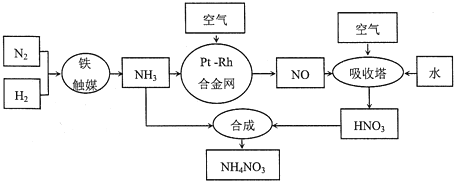
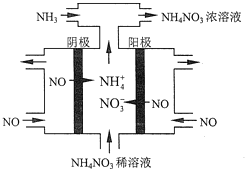
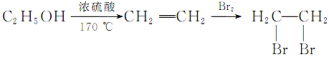题目内容
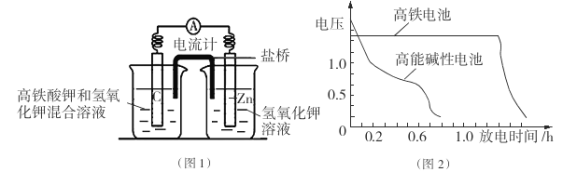
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
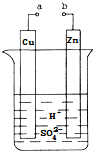
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
【答案】(1)正; 2H++2e-=H2↑;氧化; Cu;
(2)6.5;
(3)否;此反应为非氧化还原反应,且反应吸热.
【解析】
试题分析:(1)a和b用导线连接,锌的活动性位于铜的前面,所以锌发生氧化反应,作原电池的负极,铜作原电池的正极,电极反应式为2H++2e- = H2↑,原电池中阳离子向正极移动,即向铜极移动,答案为:正; 2H++2e-=H2↑;氧化; Cu;
(2)锌被腐蚀的实质是Zn-2e-=Zn2+,所以转移0.2mol电子,被氧化的锌的物质的量为0.1mol,Zn片减少的质量为6.5g,答案为:6.5g;
(3)原电池必须要能够发生自发的氧化还原反应才可以,并且原电池是将化学能转化为电能的装置,要求是放热反应,所以把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池不可行,因为此反应为非氧化还原反应,且为吸热反应,答案为:否;此反应为非氧化还原反应,且反应吸热.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目