题目内容
【题目】锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是磷酸铁锂生产的主要方法。通常以铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛的保护中先经过较低温预分解,再经高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4═2NH3↑+3CO2↑+______+_______+_______
①完成上述化学方程式.
②理论上,反应中每转移0.15mol电子,会生成LiFePO4______________g;
③反应需在惰性气氛的保护中进行,其原因是______________;
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
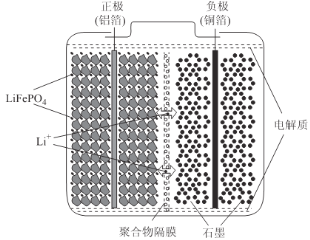
电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(3)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。(已知:法拉第常数F=96500C/mol,电流利用效率=![]() 100%)
100%)
(4)废旧磷酸亚铁锂电池的正极材料中的LiFePO4难溶于水,可用H2SO4和H2O2的混合溶液浸取,发生反应的离子方程式为______________。
【答案】
(1)①2LiFePO4+2CO↑+5H2O↑
②23.7
③防止Fe(Ⅱ)被氧化
(2)Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(3)80.4%
(4)2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O
【解析】
试题分析:(1)①由原子守恒可知,Li2CO3+2FeC2O42H2O+2NH4H2PO4 ═2LiFePO4+2NH3↑+3CO2↑+2CO↑+7H2O↑;故答案为:2LiFePO4+2CO↑+5H2O↑;
②C2O42-中C的化合价为+3价,生成CO和CO2,C元素的化合价分别为+2价、+3价,生成2molCO转移2mol电子,同时生成2molLiFePO4,则当反应中每转移0.15mol电子,生成0.15molLiFePO4,其质量为23.7g;故答案为:23.7;
③亚铁离子容易被氧气氧化,所以要隔绝氧气,即反应需在惰性气氛的保护中进行;
故答案为:防止Fe(II)被氧化;
(2)电池工作时的总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜;故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜;故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(3)电解精炼铜得到铜0.32g时,即铜的物质的量为![]() =0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,所以电流利用效率=
=0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,所以电流利用效率=![]() ×100%=
×100%=![]() ×100%=80.4%,故答案为:80.4%
×100%=80.4%,故答案为:80.4%
(4)②LiFePO4中亚铁离子在酸性条件下,被双氧水氧化为铁离子,则发生反应的离子方程式为2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O;故答案为:2LiFePO4+2H++H2O2 ═2Li++2Fe3++2PO43-+2H2O。

 阅读快车系列答案
阅读快车系列答案