题目内容
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量 FeS2)为原料,生产氧化铝并获得 Fe3O4的部分工艺流程如图,下列叙述错误的是( )
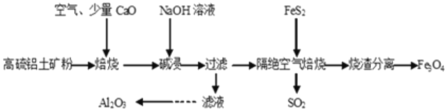
A.烧渣分离可以选择用磁铁将烧渣中的 Fe3O4 分离出来
B.隔绝空气焙烧时理论上反应消耗的 n(FeS2)∶n(Fe2O3)=1∶6
C.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得 Al2O3
D.加入 CaO 可以减少 SO2 的排放同时生成建筑材料 CaSO4
【答案】B
【解析】
由流程可知,高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,通入空气焙烧时,因为含有少量FeS2,会产生SO2,加入氧化钙达到吸收SO2的目的,防止SO2排放污染空气,焙烧产物经过NaOH溶液碱浸,Al2O3与氢氧化钠反应生成偏铝酸钠,过滤后,滤液中通入过量CO2,偏铝酸根与CO2、水反应生成氢氧化铝沉淀,洗涤后灼烧氢氧化铝即可生产Al2O3;碱浸过程中,Fe2O3不与NaOH反应,过滤后留在滤渣中,加入FeS2与Fe2O3在隔绝空气的条件下反应生成SO2和Fe3O4,利用Fe3O4的磁性实现其与烧渣的分离,以此来解答。
A.Fe3O4有磁性,可以用磁铁将Fe3O4从烧渣中分离出来,故A正确;
B.隔绝空气焙烧,FeS2与Fe2O3反应,生成SO2和Fe3O4,反应方程式为FeS2+16Fe2O3![]() 11Fe3O4+2SO2↑,由方程式可知n(FeS2):n(Fe2O3)=1:16,故B错误;
11Fe3O4+2SO2↑,由方程式可知n(FeS2):n(Fe2O3)=1:16,故B错误;
C.滤液中含有AlO2,通入过量CO2,发生反应:AlO2+CO2+2H2O=Al(OH)3↓+HCO3,生成Al(OH)3沉淀,经过过滤、洗涤后得到Al(OH)3,再灼烧Al(OH)3,反应为:2 Al(OH)3![]() Al2O3+3H2O,即可制得Al2O3,故C正确;
Al2O3+3H2O,即可制得Al2O3,故C正确;
D.铝土矿中含有FeS2,FeS2焙烧生成SO2,CaO与SO2、O2发生反应:2CaO+2SO2+O2=2CaSO4,CaSO4可用于建筑材料,故D正确;
故答案选B。