题目内容
7.一定条件下,在密闭容器中进行可逆反应:N2(g)+3H2(g)?2NH3(g),能说明该反应已达到平衡状态的是( )| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、N2和NH3的质量分数相等,并不是不变,故A错误;
B、c(NH3)保持不变,说明反应物和生成物浓度不再发生变化,正逆反应速率相等,反应达到平衡状态,故B正确;
C、平衡是各物质浓度的大小决定于开始加入物质的多少,与平衡状态无关,故C错误;
D、当体系达平衡状态时,N2、H2、NH3的浓度之比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
4.下列有关物质用途的说法正确的是( )
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
15.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )
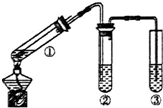

| A. | 上下移动①中铜丝可控制生成SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成 | |
| C. | ③中选用NaOH溶液吸收多余的SO2 | |
| D. | 该反应中浓硫酸表现了强氧化性和脱水性 |
2.下列物质熔沸点高低的比较,正确的是( )
| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
12.下面有关叙述不正确的是( )
| A. | 14C与14N含有相同的中子数 | |
| B. | H、D、T互为同位素 | |
| C. | 14C与C60中普通碳原子的化学性质相同 | |
| D. | 14C与12C互为同位素 |
19.下列说法正确的是( )
| A. | 分子晶体中一定存在分子间作用力 | |
| B. | 分子中含有两个氢原子的酸一定是二元酸 | |
| C. | 含有金属阳离子的晶体一定是离子晶体 | |
| D. | 元素的金属性越强,失去的电子数就越多 |
16.验证淀粉水解可生成葡萄糖,进行了下列实验,该实验中操作步骤的排列顺序正确的是①取少量淀粉加水制成溶液 ②加热煮沸 ③加入Cu(OH)2悬浊液 ④加入几滴稀硫酸 ⑤再加热 ⑥加入NaOH溶液,调PH至碱性( )
| A. | ④②⑥③⑤ | B. | ①⑤②⑥④③ | C. | ①④②⑥③⑤ | D. | ①②④⑤③⑥ |
17.根据如图提供的信息,下列所得结论正确的是( )


| A. | 该反应为吸热反应 | B. | 该反应向外界放出的热量为E1-E3 | ||
| C. | 该反应一定可以设计成为原电池 | D. | 该反应向外界放出的热量为E2-E3 |
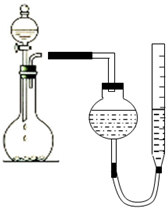 某学生用图所示的装置测定镁的相对原子质量:
某学生用图所示的装置测定镁的相对原子质量: