题目内容
12.下面有关叙述不正确的是( )| A. | 14C与14N含有相同的中子数 | |
| B. | H、D、T互为同位素 | |
| C. | 14C与C60中普通碳原子的化学性质相同 | |
| D. | 14C与12C互为同位素 |
分析 A、中子数=质量数-质子数,据此计算判断即可;
B、质子数相同,中子数不同的同种元素的不同种原子,互为同位素;
C、化学性质与最外层电子数有关,同种元素的原子化学性质相同;
D、质子数相同,中子数不同的互为同位素,据此解答即可.
解答 解:A、因中子数=质量数-质子数,14C和14N中14表示质量数,而C和N的质子数分别为6和7,因此它们的中子数分别为8、7,故A错误;
B、H、D、T均为H元素邪恶不同种原子,质子数相同,中子数不同,互为同位素,故B正确;
C、因同一种元素的化学性质是一样的,所以14C与C60中普通碳原子的化学性质相同,故C正确;
D、因同位素是质子数相同、中子数不同的原子,所以14C与12C互为同位素,故D正确;
故选A.
点评 本题主要考查的是同学们对原子结构的认识以及对同位素概念的理解,掌握:质量数=质子数+中子数是解决本题的关键,难度不大.

练习册系列答案
相关题目
8.某烃的组成为C15H24,分子结构非常对称.有关实验证明该烃中仅存在三种基团:乙烯基(-CH=CH2),亚甲基(-CH2-)和次甲基(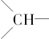 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
 ),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连.当该烃含有单环结构时,分子中的乙烯基和亚甲基数依次为( )| A. | 4、6 | B. | 2、3 | C. | 3、6 | D. | 3、3 |
3.工业上制取CuCl2的生产流程如图:
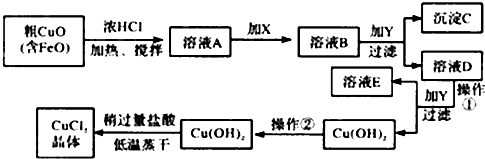
请结合表数据,回答下列问题:
①溶液A中加入X是一种“绿色”氧化剂,则X是NaClO(填化学式),其目的是氧化Fe2+生成Fe3+ 有利于沉淀分离.
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.

请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
20.关于同分异构体的叙述正确的是( )
| A. | 相对分子质量相同而结构不同的化合物互称为同分异构体 | |
| B. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| C. | 同分异构体之间由于分子组成相同,所以它们的性质相同 | |
| D. | 只有少数的有机物之间存在同分异构现象 |
7.一定条件下,在密闭容器中进行可逆反应:N2(g)+3H2(g)?2NH3(g),能说明该反应已达到平衡状态的是( )
| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |
17.已知正丁烷的二氯代物有6种同分异构体,则其八氯代物的同分异构体的数目为( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
4.下列关于有机物的说法错误的是( )
| A. | CCl4可由CH4反应得到,可萃取碘水中的碘 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
1.下列5种烃:①2-甲基戊烷 ②2,2-二甲基丙烷 ③己烷 ④庚烷 ⑤戊烷,按它们的沸点由高到低的顺序排列正确的是( )
| A. | ①>②>③>④>⑤ | B. | ②>③>⑤>④>① | C. | ④>③>②>①>⑤ | D. | ④>③>①>⑤>② |
2.实验室下列物质的保存方法中,不正确的是( )
| A. | 铝片放在不密封的容器里 | |
| B. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |