题目内容
15.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )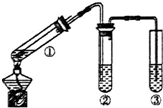
| A. | 上下移动①中铜丝可控制生成SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成 | |
| C. | ③中选用NaOH溶液吸收多余的SO2 | |
| D. | 该反应中浓硫酸表现了强氧化性和脱水性 |
分析 A.上下移动①中铜丝可控制反应是否发生;
B.二氧化硫能使品红溶液褪色;
C.二氧化硫属于酸性氧化物,能被碱液吸收;
D.该反应中部分S元素化合价不变,部分S元素化合价由+6价变为+4价.
解答 解:A.上下移动①中铜丝可控制反应是否发生,从而控制生成SO2的量,故A正确;
B.二氧化硫能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,故B正确;
C.二氧化硫属于酸性氧化物,能和碱反应生成碱,所以能被碱液吸收,故C正确;
D.该反应中部分S元素化合价不变,部分S元素化合价由+6价变为+4价,则该反应中浓硫酸体现酸性和强氧化性,故D错误;
故选D.
点评 本题考查浓硫酸的性质,浓硫酸具有酸性、吸水性、脱水性和强氧化性,二氧化硫具有漂白性和还原性,注意漂白性和还原性区别,题目难度不大.

练习册系列答案
相关题目
11.除去镁粉中的少量铝粉,可以选用的试剂是( )
| A. | 硫酸溶液 | B. | 氨水溶液 | C. | 盐酸溶液 | D. | 氢氧化钠溶液 |
12.下列叙述中,正确的是( )
| A. | 离子化合物中不含共价键 | |
| B. | 共价化合物中不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性键不是化学键 |
3.工业上制取CuCl2的生产流程如图:
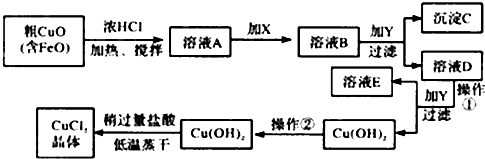
请结合表数据,回答下列问题:
①溶液A中加入X是一种“绿色”氧化剂,则X是NaClO(填化学式),其目的是氧化Fe2+生成Fe3+ 有利于沉淀分离.
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.

请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
20.关于同分异构体的叙述正确的是( )
| A. | 相对分子质量相同而结构不同的化合物互称为同分异构体 | |
| B. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| C. | 同分异构体之间由于分子组成相同,所以它们的性质相同 | |
| D. | 只有少数的有机物之间存在同分异构现象 |
7.一定条件下,在密闭容器中进行可逆反应:N2(g)+3H2(g)?2NH3(g),能说明该反应已达到平衡状态的是( )
| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |
4.下列关于有机物的说法错误的是( )
| A. | CCl4可由CH4反应得到,可萃取碘水中的碘 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
5.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应在常温下一定不能发生 | |
| B. | 已知C(s)+CO2(g)═2CO(g);△H1和C(s)+$\frac{1}{2}$O2(g)═CO(g);△H2,则△H1<△H2 | |
| C. | 已知:2SO2 (g)+O2 (g)?2SO3 (g);△H=-98.3kJ/mol.将1mol SO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量 | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 |