题目内容
2.下列物质熔沸点高低的比较,正确的是( )| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
分析 分子晶体中熔沸点与其相对分子质量成正比,含有氢键的熔沸点较高;熔沸点原子晶体>离子晶体>分子晶体,离子晶体中熔沸点与晶格能成正比,晶格能与离子电荷成正比、与离子半径成反比,据此分析解答.
解答 解:A.HF、HI都是分子晶体,但HF中含有氢键,所以熔沸点HF>HI,故A正确;
B.四氯化碳和四氟化碳都是分子晶体,且相对分子质量四氯化碳较大,所以熔沸点CCl4>CF4,故B错误;
C.二氧化硅是原子晶体、二氧化碳是分子晶体,所以熔沸点SiO2>CO2,故C错误;
D.氯化钠和氯化钾都是离子晶体,钠离子半径小于钾离子,所以晶格能氯化钠大于氯化钾,则熔沸点NaCl>KCl,故D错误;
故选A.
点评 本题考查晶体熔沸点高低判断,侧重考查学生分析判断能力,明确熔沸点与晶体类型、相对分子质量、晶格能、键长、氢键之间的关系即可解答,题目难度不大.

练习册系列答案
相关题目
18.下列物质在固态时,晶体类型相同的是( )
| A. | SiO2和CO2 | B. | NaCl和HCl | C. | I2和金刚石 | D. | NH3和H2O |
19.关于如图所示装置的叙述,错误的是( )
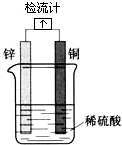

| A. | 锌是负极,其质量逐渐减轻 | |
| B. | 氢离子在铜的表面被还原,产生气泡 | |
| C. | 检流计的指针向右偏转 | |
| D. | 电流从锌片经导线流向铜片 |
7.一定条件下,在密闭容器中进行可逆反应:N2(g)+3H2(g)?2NH3(g),能说明该反应已达到平衡状态的是( )
| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |
14.下列离子反应方程式,书写正确的是( )
| A. | 向碳酸钠溶液中加过量盐酸 CO32-+2H+=H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+=H2O+CO2↑ | |
| D. | .氢氧化钡溶液中加入硫酸 H++OH-=H2O |
11.某气态烃1mol 恰好与2mol HCl加成,生成物分子中的氢又可被6mol Cl2取代,则此气态烃可能是( )
| A. | C2H2 | B. | C2H4 | C. | CH≡C-CH3 | D. | CH2=C(CH3)2 |
12.如表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是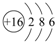 .
.
(4)用电子式表示①与⑨反应得到的化合物的形成过程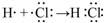 .
.
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是
 .
.(4)用电子式表示①与⑨反应得到的化合物的形成过程
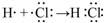 .
. 
 .
.