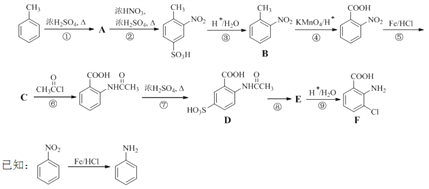
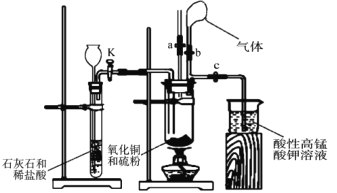
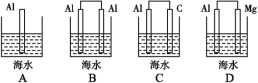
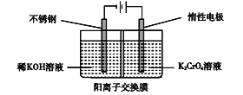
题目内容
【题目】一定温度下,硫酸盐 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(约 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀现白色浑浊,而滴入 1 滴(约 0. 05 mL) 0. 01 mol/L SrCl2 溶液无浑浊出现。下列说法中错误的是
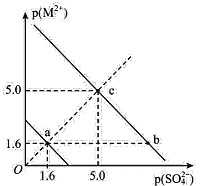
A.该温度下,溶度积常数 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c点对应BaSO4溶液移向b点,可加浓BaCl2溶液
C.欲使c点对应SrSO4溶液移向a点,可加浓SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常数为106.8
【答案】C
【解析】
由题意可知Ksp( BaSO4)=c(Ba2+)·c(SO![]() )<
)<![]()
![]() ,Ksp( SrSO4)=c(Sr2+)·c(SO
,Ksp( SrSO4)=c(Sr2+)·c(SO![]() )>
)>![]()
![]() ,可判断a 点所在直线(实线)表示SrSO4沉淀溶解平衡曲线,b、c点所在直线表示BaSO4沉淀溶解平衡曲线。
,可判断a 点所在直线(实线)表示SrSO4沉淀溶解平衡曲线,b、c点所在直线表示BaSO4沉淀溶解平衡曲线。
A.利用数据可得Ksp(BaSO4)=c(Ba2+)·c(SO![]() )=1.0×10-5×1.0×10-5=1×10-10,Ksp(SrSO4)= c(Sr2+)·c(SO
)=1.0×10-5×1.0×10-5=1×10-10,Ksp(SrSO4)= c(Sr2+)·c(SO![]() )=1.0×10-1.6×1.0×10-1.6=1×10-10=1×
)=1.0×10-1.6×1.0×10-1.6=1×10-10=1×![]() ,故A正确;
,故A正确;
B.欲使c点BaSO4饱和溶液(Ba2+、SO![]() 浓度相等)移向b点(饱和溶液),需使c(Ba2+)增大、c(SO
浓度相等)移向b点(饱和溶液),需使c(Ba2+)增大、c(SO![]() )减小,则可加入BaCl2浓溶液,故B正确;
)减小,则可加入BaCl2浓溶液,故B正确;
C.欲使c点SrSO4溶液(不饱和溶液)移向a点(饱和溶液),需使c(Sr2+)、c(SO![]() )都增大且保持相等,则需加入SrSO4固体,故C错误;
)都增大且保持相等,则需加入SrSO4固体,故C错误;
D.SrSO4(s) +Ba2+(aq)![]() BaSO4(s) +Sr2+(aq)的平衡常数K=
BaSO4(s) +Sr2+(aq)的平衡常数K=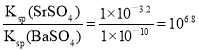 ,故D正确;
,故D正确;
答案选C。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案