题目内容
【题目】海水电池是我国1991年研制的以铝—空气—海水为能源的新型电池,可用于航海标志灯的供电。
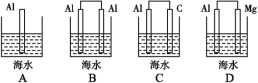
(1)下列装置的模型,能体现海水电池工作原理的是_______(填字母)。
(2)海水电池工作过程中,负极的电极反应式为____,该极是电子___(填“流出”或“流入”)的一极,发生___反应。
【答案】C Al-3e-=Al3+ 流出 氧化
【解析】
(1)铝—空气—海水电池中,铝为负极,碳为正极,海水为电解质溶液;
(2)负极铝发生氧化反应,Al失去电子生成铝离子。
(1)铝—空气—海水电池中,铝为负极,碳为正极,海水为电解质溶液,所以能体现海水电池工作原理的是C;
(2)负极发生氧化反应,Al失去电子生成铝离子,电极反应式为Al-3e-==Al3+;原电池工作时,电子从负极经外电路流向正极,铝是电子流出的一极,发生氧化反应。

【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
c(CO)(mol/L) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)反应的Q___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=___。
(3)计算在该温度下,反应的平衡常数K=___。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是___。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | ___ | ___ | ___ | 124 |
Ⅲ | 350 | ___ | ___ | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号___。