题目内容
9. (1)实验室可以测得下列热化学反应方程式:
(1)实验室可以测得下列热化学反应方程式:C(s)+O2(g)═CO2(g)△H=-394kJ•mol-1;CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1.求反应C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-111 kJ•mol-1.
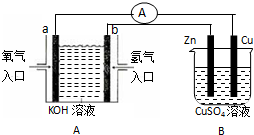
(2)氢氧燃料电池的电池反应相当于氢气在氧气中燃烧,有如图所示装置:
①装置A中b为负极,电极反应式为H2-2e-+2OH-=2H2O;
②当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L.
(3)利用反应2Cu+O2+2H2SO4?2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为4H++O2+4e-═2H2O.
分析 (1)①C(s)+O2(g)═CO2(g)△H=-394kJ•mol-1;②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1.
根据盖斯定律①-②计算;
(2)①在燃料池中,燃料氢气在b极即负极发生氧化反应;
②根据得失电子守恒计算;
(3)根据原电池原理,正极发生的是化合价降低得电子的反应.
解答 解:(1)①C(s)+O2(g)═CO2(g)△H=-394kJ•mol-1;②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1.
根据盖斯定律①-②得C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-394+283=-111 kJ•mol-1,
故答案为:-111 kJ•mol-1;
(2)①在燃料池中,燃料氢气在b极即负极发生氧化反应,反应式为:H2-2e-+2OH-=2H2O,故答案为:负;H2-2e-+2OH-=2H2O;
②根据得失电子守恒,当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为$\frac{12.8}{64}$×$\frac{1}{2}$×22.4=2.24L,故答案为:2.24;
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应为4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.
点评 本题考查原电池的工作原理以及电极反应式的书写知识,注意知识的迁移和应用是关键,难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| B. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| C. | 标准状况下22.4L任何气体都含有约6.02×1023个分子 | |
| D. | 在标准状况下1mol H2O的体积约为22.4L |
4.一定条件下,下列反应呈平衡状态时的平衡常数:K1:3H2+N2?2NH3;K2:NH3?$\frac{3}{2}$H2+$\frac{1}{2}$N2.则K1与K2的关系为( )
| A. | K22=$\frac{1}{{k}_{1}}$ | B. | K1=K2 | C. | K12=K2 | D. | 无法确定 |
14.下列说法不正确的是( )
| A. | 锌能提高脑神经的兴奋性 | B. | 钙能促进骨骼的生长发育 | ||
| C. | 缺氟能使人甲状腺肿大 | D. | 缺铁能使人贫血 |
1.下列关于有机化合物的说法正确的是( )
| A. | 糖类、油脂和蛋白质均可发生水解反应 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子均含有碳碳双键 | |
| D. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 |
19.元素周期表和元素周期律可以指导人们进行推测和判断.下列说法不合理的是( )
| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | ⅥA族元素的原子,其半径越大,气态氢化物越稳定 | |
| C. | 硅、锗都位于金属与非金属的交界处,都可以作半导体材料 | |
| D. | Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2 |
