题目内容
18.取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol•L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol•L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml•L-1盐酸恰好完全中和.计算:(1)混合物中Na2SO4的质量;
(2)混合物中Na2CO3的物质的量.
分析 (1)生成的2.33g沉淀为硫酸钡,根据硫酸根离子守恒可计算出原混合物中硫酸钠的物质的量、质量;
(2)根据消耗的盐酸、氢氧化钡的物质的量计算出碳酸钠、碳酸氢钠消耗的氯化氢的物质的量,然后根据生成的二氧化碳、消耗的氯化氢的量分别列式计算出碳酸钠的物质的量.
解答 解:(1)加入氢氧化钡溶液后生成的沉淀为硫酸钡,根据硫酸根离子守恒可知:混合物中Na2SO4的质量=$\frac{2.33g}{233g/mol}$×142g/mol=1.42g,
答:混合物中含有硫酸钠的质量为1.42g;
(2)设混合物中NaCO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量=$\frac{2.016L}{22.4L/mol}$=0.090mol,
根据碳原子守恒可知:①x+y=0.09mol,
与Na2CO3、NaHCO3反应的盐酸的物质的量为:1.0mol/L×0.25L+1mol/L×0.01L-0.1mol/L×0.5L×2=0.16mol,
则:②2x+y=0.16mol,
根据①②解得:x=0.07mol、y=0.02mol,
即:混合物中含有碳酸钠的物质的量为0.07mol,
答:混合物中含有0.07mol碳酸钠.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积、物质的量浓度等之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.下列反应属于氧化反应的是( )
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | B. | 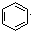 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$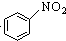 +H2O +H2O | ||
| C. | CH3CH=CH2+Br2→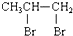 | D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
13.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 金属氧化物、氧化铁、FeO | B. | 非金属氧化物、二氧化硫、SO2 | ||
| C. | 含氧酸、硫酸、H2SO3 | D. | 碱、纯碱、Na2CO3 |
10. 化学在生产生活中应用广泛,例如:(1)2013年春季,宁夏大部分地区进行了人工降雨;(2)为预防甲状腺肿大,在食用盐中加入碘酸钾(KIO3);(3)为了减少汽车尾气对空气的污染,用乙醇代替汽油作为汽车的燃料;(4)莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示.下列说法正确的是( )
化学在生产生活中应用广泛,例如:(1)2013年春季,宁夏大部分地区进行了人工降雨;(2)为预防甲状腺肿大,在食用盐中加入碘酸钾(KIO3);(3)为了减少汽车尾气对空气的污染,用乙醇代替汽油作为汽车的燃料;(4)莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示.下列说法正确的是( )
 化学在生产生活中应用广泛,例如:(1)2013年春季,宁夏大部分地区进行了人工降雨;(2)为预防甲状腺肿大,在食用盐中加入碘酸钾(KIO3);(3)为了减少汽车尾气对空气的污染,用乙醇代替汽油作为汽车的燃料;(4)莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示.下列说法正确的是( )
化学在生产生活中应用广泛,例如:(1)2013年春季,宁夏大部分地区进行了人工降雨;(2)为预防甲状腺肿大,在食用盐中加入碘酸钾(KIO3);(3)为了减少汽车尾气对空气的污染,用乙醇代替汽油作为汽车的燃料;(4)莽草酸是合成治疗禽流感的药物--达菲(Tamifiu)的原料之一,它的一种异构体a的结构简式如图所示.下列说法正确的是( )| A. | AgI和干冰都可用于人工降雨 | |
| B. | 用米汤检验含碘食盐中是否含有碘元素 | |
| C. | 乙醇和汽油都是可再生能源 | |
| D. | 1mola能与4molNaOH完全反应 |
7.下列说法正确的是( )
| A. | 二氧化硫有漂白性,可用于加工食品使食品增白 | |
| B. | 从海水中提取碘常用过氧化氢做还原剂 | |
| C. | Na2SiO3是制备硅胶和木材防火剂的原料 | |
| D. | 铝热剂就是指铝和氧化铁的混合物 |
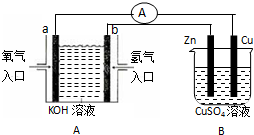 (1)实验室可以测得下列热化学反应方程式:
(1)实验室可以测得下列热化学反应方程式: 实验室配制500mL 0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的Na2SO4溶液,实验操作步骤有: