题目内容
17.按要求完整写出离子反应方程,并回答问题.(1)把供氧剂放入足量的水中:2Na2O2+2H2O═4Na++4OH-+O2↑.
(2)把铝片放入足量烧碱溶液中:2Al+2H2O+2OH-═2AlO2-+3H2↑.
(3)把铁红粉末放入足量氢碘酸中:Fe2O3+6H++2I-═I2+2Fe2++3H2O.
(4)把双氧水滴入酸性硫酸亚铁溶液中:H2O2+2Fe2++2H+═2Fe3++2H2O.
(5)在上述(1)和(4)反应中氧化物与还原产物的物质的量之比分别为1:2和1:1.
分析 (1)过氧化钠与水反应生成氢氧化钠和氧气;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(3)氧化铁与氢碘酸反应生成碘和碘化亚铁和水;
(4)硫酸亚铁与双氧水反应生成硫酸铁和水;
(5)过氧化钠与水反应生成氢氧化钠和氧气,反应中过氧化钠既做氧化剂又做还原剂,对应还原产物为水和氧气;
硫酸亚铁与双氧水反应生成硫酸铁和水,氧化产物为三价铁离子,还原产物为水,二者物质的量之比为1:1.
解答 解:(1)过氧化钠与水反应生成氢氧化钠和氧气,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑;
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑;
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(3)氧化铁与氢碘酸反应生成碘和碘化亚铁和水,离子方程式:Fe2O3+6H++2I-═I2+2Fe2++3H2O;
故答案为:Fe2O3+6H++2I-═I2+2Fe2++3H2O;
(4)硫酸亚铁与双氧水反应生成硫酸铁和水,离子方程式:H2O2+2Fe2++2H+═2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(5)过氧化钠与水反应生成氢氧化钠和氧气,反应中过氧化钠既做氧化剂又做还原剂,对应还原产物为水和氧气,方程式可表示为:2Na2O2+4H2O═4NaOH+O2↑+2H2O,所以氧化物与还原产物的物质的量之比为1:2;
硫酸亚铁与双氧水反应生成硫酸铁和水,氧化产物为三价铁离子,还原产物为水,二者物质的量之比为1:1;
故答案为:1:2 1:1.
点评 本题考查了离子方程式的书写,氧化还原反应,明确发生反应的实质及氧化产物、还原产物的概念是解题关键,注意过氧化钠与水反应的实质分析,题目难度中等.


| A. | 若Y+W→Z是非氧化还原反应,则W可能是碱溶液 | |
| B. | 若Y+W→Z是非氧化还原反应,则W可能是酸溶液 | |
| C. | 若Y+W→Z是氧化还原反应.则X可能是金属铝 | |
| D. | 若Y+W→Z是氧化还原反应,则X可能是非金属碳 |
| A. | 0.4mol•L-1 | B. | 0.43mol•L-1 | C. | 0.8mol•L-1 | D. | 1.2mol•L-1 |
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 常温条件下,在空气中铝不容易被腐蚀 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜溶液 | |
| D. | 可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 |
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | B. | 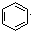 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$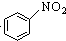 +H2O +H2O | ||
| C. | CH3CH=CH2+Br2→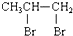 | D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
| A. | 二氧化硫有漂白性,可用于加工食品使食品增白 | |
| B. | 从海水中提取碘常用过氧化氢做还原剂 | |
| C. | Na2SiO3是制备硅胶和木材防火剂的原料 | |
| D. | 铝热剂就是指铝和氧化铁的混合物 |
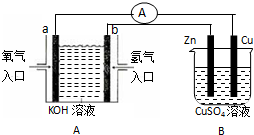 (1)实验室可以测得下列热化学反应方程式:
(1)实验室可以测得下列热化学反应方程式: