题目内容
9.电解Na2SO4溶液产生H2SO4和烧碱的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)( )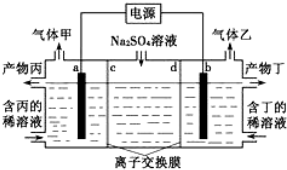
| A. | a电极反应式:2H++2e-=H2↑ | |
| B. | 产物丁为NaOH | |
| C. | c为阳离子交换膜 | |
| D. | 每转移0.2mol电子,产生1.12L气体甲 |
分析 电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH,据此分析解答.
解答 解:电解硫酸钠溶液时,阳极上生成氧气,电极反应式为2H2O-4e-=O2↑+4H+,阴极反应式为 2H2O+2e-=H2↑+2OH-,测得同温同压下,气体甲与气体乙的体积比约为1:2,则甲是氧气、乙是氢气,则a是阳极、b是阴极,阳极区域生成硫酸、阴极区域生成NaOH,
A.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,故A错误;
B.通过以上分析知,a为阳极,同时生成硫酸,所以产物丙是硫酸,b是阴极,阴极区域生成NaOH,即产物丁为NaOH,故B正确;
C.产物丁是NaOH,则离子交换膜d是阳离子交换膜,c为阴离子交换膜,故C错误;
D.a为阳极,电极反应式为2H2O-4e-=O2↑+4H+,产生的气体甲是氧气,每转移0.2mol电子,产生氧气气的物质的量为0.05mol氧气,但温度和压强未知,无法确定气体摩尔体积,则无法计算氧气体积,故D错误;
故选B.
点评 本题考查电解原理,判断甲、乙气体成分是解本题关键,再结合电极反应式分析解答,易错选项是D,注意气体摩尔体积的适用范围及适用条件,为易错点.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
20.下列叙述正确的是( )
| A. | 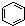 和 和 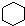 均是芳香烃, 均是芳香烃,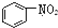 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| B. | 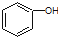 和 和 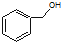 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| C. | 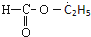 含有醛基,所以属于醛类 含有醛基,所以属于醛类 | |
| D. | 分子式为C4H10O的物质,可能属于醇类或醚类 |
17. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:R>T |
4.元素周期表里金属元素和非金属元素分界线附近能找到( )
| A. | 新制农药元素 | B. | 制催化剂元素 | ||
| C. | 制半导体元素 | D. | 制耐高温合金元素 |
14.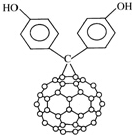 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )| A. | C60的二苯酚基化合物属于芳香烃 | |
| B. | C60的二苯酚基化合物分子式为C73H12O2 | |
| C. | C60的二苯酚基化合物能与氢氧化钠溶液反应 | |
| D. | 1mol C60的二苯酚基化合物最多可以与6mol H2发生加成反应 |
1.A是一种常见的单质.B.C为常见的化合物.A.B.C均含有元素X.它们有如图所示转化关系(部分产物及反应条件已略去)下列有关推断正确的是( )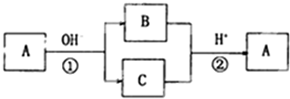
a.X元素为Al;
b.反应①和反应②互为可逆反应;
c.A可能是S或Cl2;
d.反应①和反应②一定是氧化还原反应.

a.X元素为Al;
b.反应①和反应②互为可逆反应;
c.A可能是S或Cl2;
d.反应①和反应②一定是氧化还原反应.
| A. | a和b | B. | c和d | C. | a、b、c、d | D. | b、c、d |
18.下列各项表达式中正确的是( )
| A. | Na原子简化的核外电子排布式:[Na]3s1 | |
| B. | Cr原子的价电子排布式:3d54s1 | |
| C. | NH4Cl的电子式: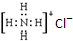 | |
| D. | Fe原子的结构示意图: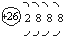 |
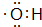 ;
; 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
.