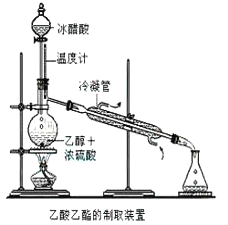
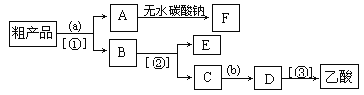
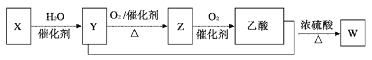
题目内容
【题目】(1)0.5 mol CH4的质量是_____________,在标准状况下的体积为____________;含电子的物质的量是_____________。
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为______________,原子个数比为_____________,密度比为_______________。
(3)下列数量的各物质所含原子数按由大到小的顺序排列是____________________。
①0.5 mol氨气 ②标准状况下22.4 L氦气
③4 ℃时9 mL水 ④0.2 mol磷酸钠(Na3PO4)
【答案】8g 11.2L 5mol 11:8 11:12 8:11 ①④③②
【解析】
(1)利用m=n×M,V=n×Vm进行计算;
(2)利用阿伏伽德罗定律及其推论进行分析,同温同压下,分子数之比等于物质的量之比,密度与摩尔质量成正比;
(3)利用以物质的量为核心的有关计算公式进行计算。
(1)m=n×M=0.5mol×16g/mol=8g;在标准状况下的体积为V=n×Vm=0.5mol×22.4L/mol=11.2L;含电子的物质的量是0.5mol×10=5mol;
(2)同温同压下,等质量的O2和CO2 ,物质的量之比为![]() :
:![]() =11:8;原子个数之比
=11:8;原子个数之比![]() =11:12,同温同压下密度与摩尔质量成正比,故密度之比是32:44=8:11;
=11:12,同温同压下密度与摩尔质量成正比,故密度之比是32:44=8:11;
(3)①0.5mol氨气中含原子为0.5mol×4=2.0mol;
②标准状况下22.4L氦气含原子为![]() =1.0mol;
=1.0mol;
③4℃时9mL水中含原子为![]() ×3=1.5mol;
×3=1.5mol;
④0.2mol磷酸钠(Na3PO4)中含原子为0.2mol×8=1.6mol;
则所含原子数按由大到小的顺序为①④③②。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程:

查阅资料:
①水合肼(N2H4·H2O)有毒且不稳定,具有强还原性和强碱性。
②有关物质的物理性质如下表:
物质 | 熔点℃ | 沸点℃ | 溶解性 |
CH3OH | -97 | 64.7 | 与水互溶 |
水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚 |
亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
叠氮化钠(NaN3) | 275 (410易分解) | —— | 易溶于水,微溶于醇, 不溶于乙醚 |
(1)合成水合肼。
实验室合成水合肼装置如图所示。NaClO碱性溶液与尿素CO(NH2)2水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。

①制取N2H4·H2O的离子方程式为_________。
②实验中通过分液漏斗滴加的溶液是_________,理由是_________。
(2)水合肼法制备叠氮化钠。
①实验室模拟工艺流程步骤Ⅰ制备叠氮化钠的反应原理为:N2H4·H2O(aq)+CH3ONO(g)+NaOH(aq)=NaN3(aq)+CH3OH(aq)+3H2O(l) △H﹤0, 研究表明该反应在20℃左右反应的选择性和转化率最高,实验时可以采取的措施是_________。
②步骤Ⅱ回收CH3OH的实验操作名称为________。
③请设计由B溶液获得叠氮化钠(NaN3)产品的实验方案:_________[实验中可供选择的试剂有:乙醇、乙醚;除常用仪器外须使用的仪器有:布氏漏斗、真空干燥箱]。