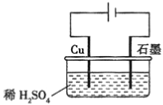
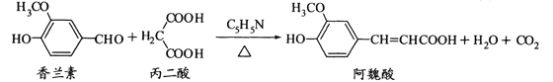
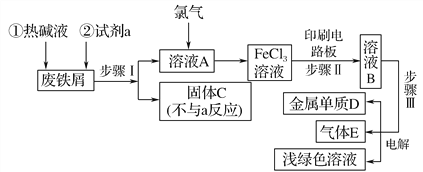
题目内容
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
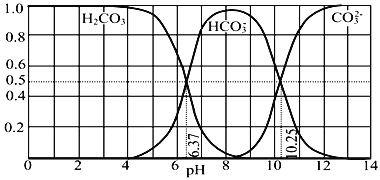
A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【答案】B
【解析】
A.根据图示可知,pH在7~9之间,溶液中主要存在HCO3-,该pH范围内和获得较纯的NaHCO3,选项A正确;B.pH=10.25时,溶质为碳酸钠和碳酸氢钠,碳酸钠溶液中满足物料守恒:c(Na+)═2c(CO32-)+2c(HCO3-)+2c(H2CO3),碳酸氢钠溶液中存在物料守恒:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),则混合液中c(Na+)>c(CO32-)+c(HCO3-),选项B错误;C.根据图象曲线可知,pH=6.37时,H2CO3和HCO3-的浓度相等,碳酸的第一步电离的平衡常数K1(H2CO3)=![]() =10-6.37,选项C正确;D.pH=10时的溶液为碱性,则c(OH-)>c(H+),溶质为碳酸钠和碳酸氢钠,c(Na+)离子浓度最大,结合图象曲线变化可知:c(HCO3-)>c(CO32-),此时离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),选项D正确;答案选B。
=10-6.37,选项C正确;D.pH=10时的溶液为碱性,则c(OH-)>c(H+),溶质为碳酸钠和碳酸氢钠,c(Na+)离子浓度最大,结合图象曲线变化可知:c(HCO3-)>c(CO32-),此时离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),选项D正确;答案选B。

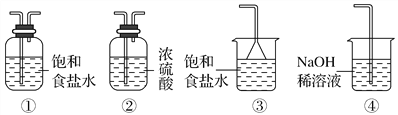
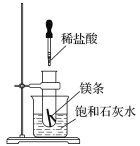
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D