题目内容
9.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 6.8 g熔融的KHSO4中含有0.05NA个阳离子 | |
| B. | 1.0 L 2 mol/L的NaOH(aq)中含有的氧原子数目为2NA | |
| C. | 在24 g18O2中含有1.5NA个氧原子 | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
分析 A、熔融硫酸氢钾电离出钾离子和硫酸氢根离子;
B、氢氧化钠水溶液中,溶剂水中同样含有氧原子;
C、依据n=$\frac{m}{M}$计算物质的量结合分子式计算原子数;
D、I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-.
解答 解:A、6.8g熔融的KHSO4的物质的量0.05mol,0.05mol熔融硫酸氢钾能够电离出0.05mol钾离子和0.05mol硫酸氢根离子,所以含有的阳离子数为0.05NA,故A正确;
B、1.0L 2mol/L的NaOH水溶液中含有溶质氢氧化钠2mol,由于溶剂水中也含有氧原子,所以无法计算溶液中含有的氧原子的物质的量及数目,故B错误;
C、依据n=$\frac{m}{M}$计算物质的量=$\frac{24g}{36g/mol}$=$\frac{2}{3}$mol,结合分子式计算原子数含有2×$\frac{2}{3}$NA个氧原子,故C错误;
D、在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故D错误.
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
19.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中,X元素的化合价为( )
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
20.下列物质加入到氢氧化钠溶液中,有气体生成的是( )
| A. | 金属钠 | B. | 过氧化钠 | C. | 金属镁 | D. | 金属铝 |
17.利用如图所示的有机物X可生产S-诱抗素Y.下列说法正确的是( )
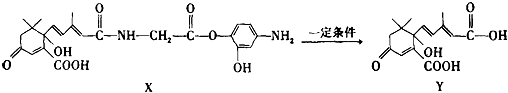

| A. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | X结构中有2个手性碳原子 |
4.类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否.下列几种类推结论中正确的是( )
| A. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 | |
| B. | SiO2晶体熔化时破坏的是共价键;所以CO2晶体熔化时破坏的也是共价键 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝 | |
| D. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 |
14.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现119号元素,请在“元素大厦”中安排好它的“房间”( )
| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
1.实验室下列物质的保存方法中,不正确的是( )
| A. | 氢氧化钠溶液盛装在用橡胶塞的试剂瓶中 | |
| B. | 氢氟酸盛装在细口玻璃瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
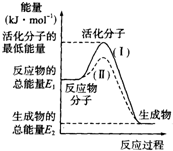 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.