��Ŀ����
6��Ϊ���������ܼ��š��͡���̼���á������ʹ�����C02�ĺ�������Ч�ؿ�������C02��ѧ�������о���ν�C02ת��Ϊ�����õ���Դ��Ŀǰ��ҵ����һ�ַ�������C02������ȼ�ϼ״���һ�������·�����ӦCO2��g��+3H2��g��?CH3OH��g��+H2O��g����ͼ1��ʾ�÷�Ӧ��������������λΪkJ��mol-1���ı仯����1�����ڸ÷�Ӧ������˵���У���ȷ����C������ĸ����
A����H��0����S��0 B����H��O����S��0
C��H��O����S��O D����H��0����S��0
��2��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ3L���ܱ������У�����1molCO2��3molH2��һ������������Ӧ��C02��g��+3H2��g��?CH3OH��g��+H20��g���������CO2��CH3OH��g����Ũ����ʱ��仯��ͼ2��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬CO2��ƽ����Ӧ����v��CO2��=0.025mol/��L��min����
�ڴ������£��÷�Ӧ��ƽ�ⳣ��K=48��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ�����BD��
A�������¶�
B����CH3OH��g����ʱҺ�����
C��ѡ���Ч����
D������������ٳ���1molCO2��3mol H2
��3��25�棬1.01��105Paʱ��16gҺ̬�״���ȫȼ�գ����ָ���ԭ״̬ʱ���ų�369.2kJ��������д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽCH3OH��l��+$\frac{3}{2}$O2��g���TCO2��g��+2H2O��l����H=-738.4 kJ•mol-1��
��4��ѡ�ú��ʵĺϽ�Ϊ�缫�����������ơ�������ˮ������Ϊԭ�ϣ������Ƴ�һ���Լ״�Ϊԭ�ϵ�ȼ�ϵ�أ��˵�صĸ���Ӧ�����ͨ��������м״����������ƣ��������ĵ缫��Ӧʽ��O2+2H2O+4e-�T4OH-��
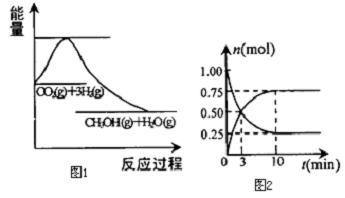
���� ��1������Ӧ���������ʵ�����С�ķ�Ӧ����Ϊ�ؼ��ķ�Ӧ����ͼ��֪��Ӧ����������������������������Ϊ���ȷ�Ӧ��
��2�������Ϊ3L���ܱ������У�����1molCO2��3molH2��10min�ﵽƽ�⣬ƽ��ʱ������̼Ϊ0.25mol���״�Ϊ0.75mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ����mol����1 3 0 0
�仯����mol����0.75 2.25 0.75 0.75
ƽ������mol����0.25 0.75 0.75 0.75
�ٸ���v=$\frac{��c}{��t}$����v��CO2����
��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$��
��A�������¶�ƽ�������ȷ�Ӧ�ƶ���
B����CH3OH��g����ʱҺ�������������Ũ�ȼ�С��ƽ�������ƶ���
C��ѡ���Ч������Ӱ��ƽ���ƶ���
D������������ٳ���1molCO2��3mol H2����Ӧ��Ũ������ƽ�������ƶ���
��3������1mol�״�ȼ�շų���������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��ע��״��Ļ�ѧ������Ϊ1��
��4�������Ǽ״�ȼ�����ɶ�����̼��ˮ��������̼���������Ʒ�Ӧ����̼���ƣ�ԭ��ظ�������������Ӧ��Ӧ�ڸ�������״����������ƣ������ϻ�ԭ��Ӧ��������������õ��ӣ������������������������ӣ�
��� �⣺��1������Ӧ���������ʵ�����С�ķ�Ӧ����Ϊ�ؼ��ķ�Ӧ������S��0����ͼ��֪��Ӧ����������������������������Ϊ���ȷ�Ӧ�����H��0��
��ѡ��C��
��2�������Ϊ3L���ܱ������У�����1molCO2��3molH2��10min�ﵽƽ�⣬ƽ��ʱ������̼Ϊ0.25mol���״�Ϊ0.75mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ����mol����1 3 0 0
�仯����mol����0.75 2.25 0.75 0.75
ƽ������mol����0.25 0.75 0.75 0.75
��v��CO2��=$\frac{\frac{0.75mol}{3L}}{10min}$=0.025mol/��L��min�����ʴ�Ϊ��0.025mol/��L��min����
��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{\frac{0.75}{3}��\frac{0.75}{3}}{\frac{0.25}{3}����\frac{0.75}{3}��^{3}}$=48���ʴ�Ϊ��48��
��A������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ�����A����
B����CH3OH��g����ʱҺ�������������Ũ�ȼ�С��ƽ�������ƶ�����B��ȷ
C��ѡ���Ч�����ӿ췴Ӧ���ʣ���Ӱ��ƽ���ƶ�����C����
D������������ٳ���1molCO2��3mol H2����Ӧ��Ũ������ƽ�������ƶ�����D��ȷ��
��ѡ��BD��
��3��1mol�״�ȼ�շų�������Ϊ369.2kJ��$\frac{1mol��32g/mol}{16g}$=738.4 kJ���״�ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH3OH��l��+$\frac{3}{2}$O2��g���TCO2��g��+2H2O��l����H=-738.4 kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g���TCO2��g��+2H2O��l����H=-738.4 kJ•mol-1��
��4�������Ǽ״�ȼ�����ɶ�����̼��ˮ��������̼���������Ʒ�Ӧ����̼���ƣ�ԭ��ظ�������������Ӧ��Ӧ�ڸ�������״����������ƣ������ϻ�ԭ��Ӧ��������������õ��ӣ������������������������ӣ������缫��ӦʽΪ��O2+2H2O+4e-�T4OH-��
�ʴ�Ϊ���״����������ƣ�O2+2H2O+4e-�T4OH-��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ���ʼ��㡢ƽ�ⳣ�����Ȼ�ѧ����ʽ��д��ԭ��صȣ��ǶԻ���֪ʶ���ۺϿ��飬�Ѷ��еȣ�

 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�| A�� | ����е�NaOH��Һ�еμ�FeCl3������Һ�Ʊ�Fe��OH��3���� | |
| B�� | �����˶��ǽ����������е��˶���ʽ�����Ծݴ˰ѽ�������Һ������Һ���� | |
| C�� | �������е�ɣ�����������ɢϵ���ǵ����Ե� | |
| D�� | �������Ӻ�С����������Ĥ |
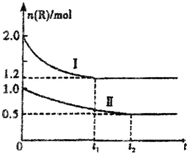 ��ס������������ͬ�ĺ��������У��ֱ����2mol����R��1mol����R����ͬ�¶��£��������з�Ӧ��xR?M+N������ӦΪ���ȷ�Ӧ������������R�����ʵ�����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
��ס������������ͬ�ĺ��������У��ֱ����2mol����R��1mol����R����ͬ�¶��£��������з�Ӧ��xR?M+N������ӦΪ���ȷ�Ӧ������������R�����ʵ�����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �������£���ʹ�����и����ʵ���������ﵽ��ͬ | |
| B�� | x=2����M��N�н���һ��Ϊ��̬ | |
| C�� | ����IIΪ����R�����ʵ���һʱ��ͼ�� | |
| D�� | ������������ʱ���������ټ���1mol M��1molN���ﵽ��ƽ��ʱ������1.0mol��n��R����1.2 mol |
| A�� | �����������AgNO3��Һ�У������е���ɫ�������� | |
| B�� | ��������NaOH��ˮ��Һ���ȿ���ȡ��ϩ | |
| C�� | ������������ˮ�������ڶ����л��ܼ� | |
| D�� | ʵ����ͨ������ϩ����ˮ��Ӧ����ȡ������ |
��N2��g��+2O2��g���T2NO2��g������H=+67.7kJ?mol-1
��N2H4��g��+O2��g���TN2��g��+2H2O��g������H=-534kJ?mol-1
��H2O��l���TH2O��g������H=+44kJ?mol-1
���º�NO2��ȫ��Ӧ����2molH2O��l��ʱ���ų�������Ϊ��������
| A�� | 100.3 kJ | B�� | 327.9 kJ | C�� | 655.9 kJ | D�� | 600.8 kJ |