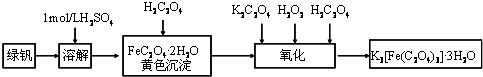
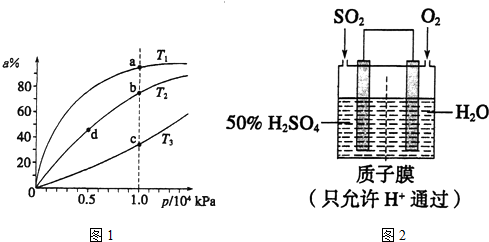
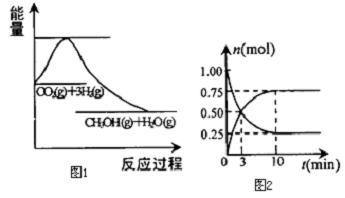
题目内容
1.某温度下,在2L容积固定的密闭容器中充入2mol N2和7mol H2,10min后达到平衡状态,此时测得反应物的物质的量之和等于生成物的物质的量,且放出QkJ的热量.回答下列问题(1)平衡时氨气的物质的量浓度为1.5mol/L.
(2)平衡时N2的转化率为75%.
(3)写出N2与H2反应合成NH3的热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-$\frac{2}{3}$Q kJ/mol.
分析 某温度下,在2L容积固定的密闭容器中充入2mol N2和7mol H2,10min后达到平衡状态,测得反应物的物质的量之和等于生成物的物质的量,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 7 0
变化量(mol):x 3x 2x
平衡量(mol):2-x 7-3x 2x
所以2-x+7-3x=2x,解得x=1.5
(1)根据c=$\frac{n}{V}$计算平衡时氨气浓度;
(2)氮气转化率=$\frac{反应的氮气物质的量}{氮气起始物质的量}$×100%;
(3)1.5mol氮气反应放出热量为QkJ,则1mol氮气反应放出的热量为$\frac{2}{3}$QkJ,注明物质聚集状态与焓变书写热化学方程式.
解答 解:某温度下,在2L容积固定的密闭容器中充入2mol N2和7mol H2,10min后达到平衡状态,测得反应物的物质的量之和等于生成物的物质的量,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 7 0
变化量(mol):x 3x 2x
平衡量(mol):2-x 7-3x 2x
所以2-x+7-3x=2x,解得x=1.5
(1)平衡时氨气浓度为$\frac{3mol}{2L}$=1.5mol/L,故答案为:1.5mol/L;
(2)氮气转化率=$\frac{1.5mol}{2mol}$×100%=75%,故答案为:75%;
(3)1.5mol氮气反应放出热量为QkJ,则1mol氮气反应放出的热量为$\frac{2}{3}$QkJ,热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-$\frac{2}{3}$Q kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-$\frac{2}{3}$Q kJ/mol.
点评 本题考查化学平衡计算、热化学方程式书写,难度不大,注意对基础知识的理解掌握.

| A. | 此钢瓶的容积为44.8L | |
| B. | 此钢瓶的质量为15g | |
| C. | 气体X对氢气的相对密度为22 | |
| D. | 该状况下此钢瓶中盛满氯气时的总质量为142g |
| A. | 将混合气体通过盛有酸性KMnO4溶液的洗气瓶 | |
| B. | 将混合气体通过盛有适量溴水的洗气瓶 | |
| C. | 将混合气体中通入氢气,在Ni催化加热的条件下反应 | |
| D. | 将混合气体通过盛有NaOH溶液的洗气瓶 |
| A. | 将342g 蔗糖(C12H22O11)溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| B. | 将1L2mol/L H2SO4溶液加水稀释到2L,所得溶液的物质的量浓度为1mol/L | |
| C. | 将1L 8.4 mol/L的H2SO4溶液加入到1L水中,所得溶液的物质的量浓度为9.2mol/L | |
| D. | 将336mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05mol/L |