题目内容
11.氮化铝(AlN)陶瓷是一种类金刚石氮化物的新型无机非金属材料,最高可稳定到2200℃,导热性好,热膨胀系数小,是良好的耐热冲击材料.抗熔融金属侵蚀的能力强,是熔铸纯铁、铝或铝合金理想的坩埚材料.工业用氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.现要通过实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).(1)实验原理
①已知Al4C3与硫酸反应可生成CH4,则该反应的离子方程式是Al4C3+12H+=4Al3++3CH4↑.
②AlN溶于强酸生成铵盐,溶于氢氧化钠溶液生成氨气,
请写出AlN与NaOH溶液反应的化学方程式.
(2)实验装置(如图所示)
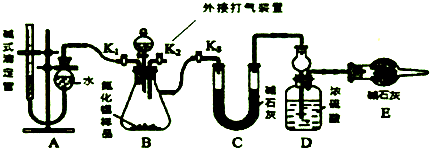
(3)实验过程
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL.
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入过量H2SO4(填化学式),与锥形瓶内物质充分反应.
③待反应进行完全后,关闭活塞K1,打开活塞K3,通过分液漏斗加入过量NaOH(填化学式),
与锥形瓶内物质充分反应.
④打开K2,通过打气装置通入空气一段时间.
⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据处理与问答
①在上述装置中,设置活塞K2的目的是打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收.
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积偏小填“偏大”,“偏小”或“无影响”).
③Al4C3的质量分数为$\frac{0.048(a-b)}{{V}_{m}•X}$×100%,AlN的质量分数为$\frac{41(Z-Y)}{17X}$×100%.
分析 从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数,以此分析解答;
(1)①Al4C3与硫酸反应可生成CH4和硫酸铝;
②根据题目信息:AlN溶于强碱溶液时会生成NH3来书写方程式;
(3)②关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量;
③关闭活塞K1,打开活塞K3,用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量;
(4)①通入空气一段时间,排尽装置的氨气,被装置D完全吸收;
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小;
③根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,可求得Al4C3的质量分数,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数.
解答 解:从实验装置和实验步骤上看,本实验的原理是用足量硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数;
(1)①碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷,碳化铝与硫酸反应可理解为碳化铝(Al4C3)与水反应,产物再和硫酸反应,所以产物为硫酸铝和甲烷,反应方程式为:Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑,离子方程式为:Al4C3+12H+=4Al3++3CH4↑,
故答案为:Al4C3+12H+=4Al3++3CH4↑;
②根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)②关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入稀硫酸,硫酸与样品中Al4C3完全反应,量取生成的甲烷气体,从而测得Al4C3的百分含量,
故答案为:H2SO4;
③关闭活塞K1,打开活塞K3,用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,
故答案为:NaOH;
(4)①装置中残留部分氨气,打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收,防止测定的氨气的质量偏小,
故答案为:打开K2,通入空气一段时间,排尽装置的氨气,被装置D完全吸收;
②读取滴定管中气体的体积时,液面左高右低,气体的压强大于大气压,测定气体甲烷的体积偏小,
故答案为:偏小;
③甲烷的体积为(a-b)mL,物质的量为$\frac{(a-b)×1{0}^{-3}}{{V}_{m}}$mol,根据碳原子的守恒,Al4C3的物质的量等于甲烷的物质的量的三分之一,所以Al4C3的质量为$\frac{1}{3}$×$\frac{(a-b)×1{0}^{-3}}{{V}_{m}}$mol×144g/mol=$\frac{48(a-b)×1{0}^{-3}}{{V}_{m}}$g,Al4C3的质量分数为$\frac{0.048(a-b)}{{V}_{m}•X}$×100%,
氨气的质量为(z-y)g,物质的量为$\frac{Z-Y}{17}$mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为$\frac{Z-Y}{17}$mol×41g/mol=$\frac{41(Z-Y)}{17}$g,故AlN的质量分数为$\frac{\frac{41(Z-Y)}{17}}{X}$×100%=$\frac{41(Z-Y)}{17X}$×100%,
故答案为:$\frac{0.048(a-b)}{{V}_{m}•X}$×100%;$\frac{41(Z-Y)}{17X}$×100%.
点评 本题是一道关于物质的组成和含量测定知识的综合考查题,侧重考查学生知识综合应用能力,要求学生具有分析和解决问题的能力,综合性较强,注意把握相关实验原理,题目难度大.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案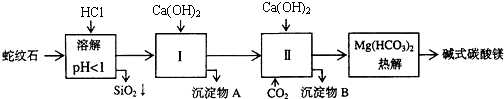
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是CaCO3或CO2(填写物质化学式).
(5)若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数升高(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量大于84).
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 | |
| B. | 浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 | |
| C. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| D. | SO2具有漂白性,能使紫色KMnO4溶液褪色 |
| A. | 金属钠和水反应 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 将四氧化三铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将过量铁粉和稀硝酸混合:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
| A. | 玛瑙手镯、水晶项链、餐桌上的陶瓷碗盘都是硅酸盐制品 | |
| B. | 二氧化硅晶体广泛用于制作太阳能电池和光导纤维 | |
| C. | 制造水泥、玻璃的原料都有石灰石、纯碱、石英 | |
| D. | 粗硅制备单晶硅涉及氧化还原反应 |