��Ŀ����
����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£� ����ȡ50mL 0.25mol/L H2SO4��Һ����С�ձ��У������¶ȣ�
����ȡ50mL 0.55mol/L NaOH��Һ�������¶ȣ�
�۽�NaOH��Һ����С�ձ��У���Ͼ��Ⱥ�������Һ�¶ȣ���ش�
��1����ͼ��ʾ������A���������� 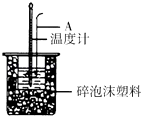
��2��NaOH��Һ�Թ�����ԭ�� ��
��3������NaOH��Һ����ȷ������������ĸ����
A.�ز�������������
B.һ��Ѹ�ټ���
C.�������
��4��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������ ��
��5������Һ���ܶȾ�Ϊ1gcm��3 �� �кͺ���Һ�ı�����c=4.18J��g�棩��1 �� �����ʵ������д�����к��ȵ��Ȼ�ѧ����ʽ
�¶� | ��ʼ�¶�t1/�� | ��ֹ�¶� | �¶Ȳ�ƽ��ֵ | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
��6������ʵ����ֵ�����57.3kJ/mol��ƫ�����ƫ���ԭ������ǣ�����ĸ�� a��ʵ��װ�ñ��¡�����Ч����
b���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
c�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
��7����������ȷ����ȡ���Һ������¶ȣ� ��
���𰸡�
��1������������
��2��ȷ�����ᱻ��ȫ�к�
��3��B
��4���û��β������������
��5��H2SO4��aq��+2NaOH��aq��Na2SO4��aq��+2H2O��l����H=��113.7kJ?mol��1
��6��abc
��7�����϶�ȡ�¶����ݣ�����¼��ֱ�������½���ȡ���ֵ
���������⣺��1����ͼ��ʾ������A�������ǻ��β���������� ���Դ��ǣ����β������������2��ʵ���У�����NaOH�Թ�����ԭ����ȷ�����������ᷴӦ��ȫ�����Դ��ǣ�ȷ�����ᱻ��ȫ�кͣ���3����������������Һʱ������һ��Ѹ�ٵĵ��룬Ŀ���Ǽ���������ɢʧ�����ּܷ��ε�������������Һ������ᵼ������ɢʧ��Ӱ��ⶨ��������Դ��ǣ�B����4��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ���������ǣ��������¶ȼ��ϵĻ��β������������ؽ������¶ȼ��Dz����¶ȵģ����Դ��ǣ��û��β����������������5����1��ʵ��H2SO4��NaOH��Һ��ʼƽ���¶�Ϊ25.1�棬��Ӧ���¶�Ϊ28.5�棬��Ӧǰ���¶Ȳ�Ϊ3.4�棻��2��ʵ��H2SO4��NaOH��Һ��ʼƽ���¶�Ϊ25.0�棬��Ӧ���¶�Ϊ28.3�棬��Ӧǰ���¶Ȳ�Ϊ3.3�棻��3��ʵ��H2SO4��NaOH��Һ��ʼƽ���¶�Ϊ26.0�棬��Ӧ���¶�Ϊ31.8�棬��Ӧǰ���¶Ȳ�Ϊ5.8�棻��4��ʵ��H2SO4��NaOH��Һ��ʼƽ���¶�Ϊ25.5�棬��Ӧ���¶�Ϊ29.0�棬��Ӧǰ���¶Ȳ�Ϊ3.5�棻��3��ʵ�����ϴ���ȥ����������ʵ���ƽ��ֵΪ ![]() ��=3.4�棬Q=��H=����Tcm=��3.4���4.18J/��g�棩��100mL��1g/mL�T1.4212kJ/mol��50moL 0.25molL��1������50mL 0.55mol/L NaOH��Һ���кͷ�Ӧ����ˮ�����ʵ�����0.025mol����������2molˮ�ų�������Ϊ��
��=3.4�棬Q=��H=����Tcm=��3.4���4.18J/��g�棩��100mL��1g/mL�T1.4212kJ/mol��50moL 0.25molL��1������50mL 0.55mol/L NaOH��Һ���кͷ�Ӧ����ˮ�����ʵ�����0.025mol����������2molˮ�ų�������Ϊ�� ![]() ��2=113.7kJmol��1 �� �����Ȼ�ѧ����ʽΪ��H2SO4��aq��+2NaOH��aq��Na2SO4��aq��+2H2O��l����H=��113.7kJmol��1 �� ���Դ��ǣ�H2SO4��aq��+2NaOH��aq��Na2SO4��aq��+2H2O��l����H=��113.7kJmol��1����6��a��װ�ñ��¡�����Ч�����õ�����ƫС���к��ȵ���ֵƫС����a��ȷ��b���ֶ�ΰ�NaOH��Һ����ʢ��ϡ�����С�ձ��У�����ɢʧ�ϴ������к��ȵ���ֵƫС����b��ȷ��c���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳ���ϡH2SO4���¶ȣ��������ʼ�¶�ƫ�ߣ��¶Ȳ�ƫС����õ�����ƫС���к��ȵ���ֵƫС����c��ȷ�����Դ��ǣ�abc����7�����϶�ȡ�¶����ݣ�����¼��ֱ�������½���ȡ���ֵ��Ϊ���Һ������¶ȣ����Դ��ǣ����϶�ȡ�¶����ݣ�����¼��ֱ�������½���ȡ���ֵ��
��2=113.7kJmol��1 �� �����Ȼ�ѧ����ʽΪ��H2SO4��aq��+2NaOH��aq��Na2SO4��aq��+2H2O��l����H=��113.7kJmol��1 �� ���Դ��ǣ�H2SO4��aq��+2NaOH��aq��Na2SO4��aq��+2H2O��l����H=��113.7kJmol��1����6��a��װ�ñ��¡�����Ч�����õ�����ƫС���к��ȵ���ֵƫС����a��ȷ��b���ֶ�ΰ�NaOH��Һ����ʢ��ϡ�����С�ձ��У�����ɢʧ�ϴ������к��ȵ���ֵƫС����b��ȷ��c���¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳ���ϡH2SO4���¶ȣ��������ʼ�¶�ƫ�ߣ��¶Ȳ�ƫС����õ�����ƫС���к��ȵ���ֵƫС����c��ȷ�����Դ��ǣ�abc����7�����϶�ȡ�¶����ݣ�����¼��ֱ�������½���ȡ���ֵ��Ϊ���Һ������¶ȣ����Դ��ǣ����϶�ȡ�¶����ݣ�����¼��ֱ�������½���ȡ���ֵ��

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�����Ŀ���Թ�����Ϊ�����������������V2O5���ǽӴ�����������Ĵ������ӷϷ������л���V2O5�ȱ�����Ⱦ����
����������Դ�ۺ����ã��Ϸ���������Ҫ�ɷ�Ϊ��
���� | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
��������/% | 2.2��2.9 | 2.8��3.1 | 22��28 | 60��65 | 1��2 | ��1 |
������һ�ַϷ��������չ���·�ߣ�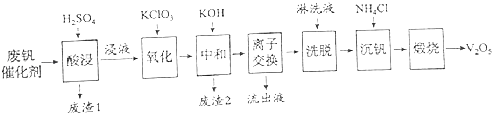
�ش��������⣺
��1���������ʱV2O5ת��ΪVO2+ �� ��Ӧ�����ӷ���ʽΪ �� ͬʱV2O4ת��VO2+ �� ������1������Ҫ�ɷ��� ��
��2��������������ʹ3 mol��VO2+��ΪVO2+ �� ����Ҫ������KClO3����Ϊmol��
��3�����к͡�����֮һ��ʹ����V4O124����ʽ��������Һ�У�������2���к��� ��
��4�������ӽ������͡�ϴ�ѡ��ɼ�ʾΪ��4ROH+V4O124��![]() R4V4O12+4OH������ROHΪǿ���������ӽ�����֬����Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó��ԣ���ᡱ������С�����
R4V4O12+4OH������ROHΪǿ���������ӽ�����֬����Ϊ�����ϴ��Ч�ʣ���ϴҺӦ�ó��ԣ���ᡱ������С�����
��5��������Һ���������������� ��
��6�����������õ�ƫ����泥�NH4VO3��������д�������ա��з�����Ӧ�Ļ�ѧ����ʽ ��