题目内容
【题目】Cl2和SO2都能使品红溶液褪色。若将等物质的量的Cl2、SO2混合后,再通入品红与BaCl2的混合溶液,能观察到的现象是①溶液很快褪色②溶液不褪色 ③出现沉淀④不出现沉淀
A. ①② B. ①③ C. ②③ D. ②④
【答案】C
【解析】Cl2和SO2都具有漂白性,但两者混合后发生反应:Cl2+SO2+2H2O=H2SO4+2HCl;H2SO4和HCl都不具有漂白性,因此将混合气体通入品红溶液中不会使溶液褪色,而通入BaCl2溶液中则可以生成BaSO4沉淀,故选C。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】某学习小组通过下面的实验一和实验二,探究某些化学理论.
(1)实验一:以反应2Fe3++2I﹣=2Fe2++I2为例, 探究该反应是否为可逆反应.
实验方法:在KI溶液中滴加3mLFeCl3溶液,将混合液均
匀分到甲、乙、丙三支试管中;往试管甲中滴加淀粉
溶液,往试管乙中滴加KSCN溶液.如图所示: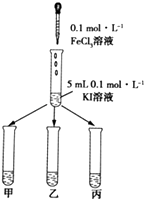
若试管甲中出现现象;
乙试管中出现现象,
则说明该反应为可逆反应.
(2)实验二:实验室制备CO2的反应.实验过程中的数据及相关信息如下表:
序号 | 反应温度/℃ | C(HCl)/molL﹣1 | V(HCl)/mL | 10g碳酸钙的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t 1 |
② | 20 | 4 | 10 | 块状 | t 2 |
③ | 20 | 2 | 10 | 粉末 | t 3 |
④ | 40 | 2 | 10 | 粉末 | t 4 |
⑤ | 40 | 4 | 10 | 粉末 | t5 |
※t表示收集相同状况下体积都为a mL CO2所需的时间※
(i)由表格中的信息可知实验二的目的是探究
(ii)实验①和实验②是探究对该化学反应速率的影响,分析表格中的信息可知,对该化学反应速率的影响因素还有
(iii)收集a mL CO2所需的时间最少的实验是(填实验序号)
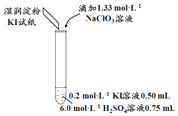
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 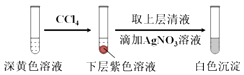
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 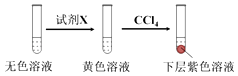
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
【题目】利用如图装置测定中和热的实验步骤如下: ①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是; 
(2)NaOH溶液稍过量的原因 .
(3)加入NaOH溶液的正确操作是(填字母).
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 .
(5)设溶液的密度均为1gcm﹣3 , 中和后溶液的比热容c=4.18J(g℃)﹣1 , 请根据实验数据写出该中和热的热化学方程式
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度? .
【题目】向氯水中加入下列物质,表中各项均正确的是( )
选项 | 加入物质 | 现象 | 解释或离子方程式 |
A | AgNO3溶液 | 有白色沉淀生成 | Cl﹣+Ag+═AgCl↓ |
B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
C | CaCO3 | 有气体放出 | CO |
D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl﹣ |
A.A
B.B
C.C
D.D