题目内容
10.有第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依A、B、C、D依次增大.已知A与B的次外层电子数为8,而C与D 为18.根据原子结构,判断:(1)哪些是金属元素?
(2)D与A的简单离子是什么?
(3)哪种元素的氢氧化物碱性最强?
(4)B与D的两原子间能形成何种化合物?写出化学式.
分析 第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D顺序增大,A有B的次外层电子数为8,则A是K元素、B是Ca元素,而C与D的次外层电子数为18,则C是Zn元素、D是Br元素,再结合物质的性质、元素周期律解答.
解答 解:第4周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数按A、B、C、D顺序增大,A有B的次外层电子数为8,则A是K元素、B是Ca元素,而C与D的次外层电子数为18,则C是Zn元素、D是Br元素,
(1)通过以上分析知,A、B、C、D分别是钾、钙、锌、溴,所以金属元素为:钾、钙、锌,答:金属元素有钾、钙、锌;
(2)D是Br元素,溴原子得到一个电子生成溴离子,所以其简单离子是Br-,A是钾,失去一个电子,变成钾离子,答:D与A的简单离子分别是Br-和K+;
(3)元素的金属性越强,其最高价氧化物的水化物碱性越强,这四种元素中金属性最强的是K元素,所以碱性最强的是KOH,答:钾元素的氢氧化物碱性最强;
(4)B原子与D原子间形成化合物是溴化钙,溴化钙的化学式为CaBr2,B与D可形成离子化合物,答:B与D的两原子间能形成离子化合物,化学式为CaBr2.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及电离能大小比较、碱性强弱等知识点,熟悉原子结构并根据原子结构确定元素是解本题关键,注意第一电离能变化规律及异常现象,为易错点.

练习册系列答案
相关题目
20.能用离子方程式:CO32-+2H+═CO2↑+H2O来表示的是( )
| A. | 碳酸钡与盐酸反应 | B. | 碳酸钾溶液与醋酸溶液反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
1.同物质的量浓度同体积的Na2CO3和NaHCO3溶液中,分别加入足量等体积等浓度的盐酸,结果是( )
| A. | Na2CO3产生的CO2多 | B. | NaHCO3产生的CO2多 | ||
| C. | NaHCO3的反应速率快 | D. | 二者产生CO2一样多 |
18.下列溶液一定显碱性的是( )
| A. | 溶液中无H+ | B. | 溶液中pH>7 | C. | 溶液中只有OH- | D. | 溶液中c(OH-)>c(H+) |
5.关于CO2说法正确的是( )
| A. | 碳原子采取sp杂化 | B. | CO2晶胞是体心结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
15.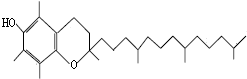 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )| A. | 维生素E的化学式为:C29H50O2 | |
| B. | 维生素E的还原性主要是酚羟基表现出来,若被酯化后就不具有抗氧化活性 | |
| C. | 维生素E易溶于水和乙醇、苯等有机溶剂 | |
| D. | 维生素E虽含有酚羟基,但不能与溴水反应 |
2.不粘锅的内壁有一薄层为聚四氟乙烯的涂层,用不粘锅烹烧饭菜时不易粘锅、烧焦.下列关于聚四氟乙烯的说法正确的是( )
| A. | 聚四氟乙烯的化学活动性很强 | B. | 聚四氟乙烯分子中含有双键 | ||
| C. | 聚四氟乙烯的单体是不饱和烃 | D. | 聚四氟乙烯中氟的质量分数是76% |
20.一定温度下,向2.0L恒容密闭容器中充入1.0mol A,经一段时间后反应A(g)?B(g)+C(g)达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50 s内B的平均反应速率v(B)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol•L-1,则反应的△H<0 |