题目内容
20.一定温度下,向2.0L恒容密闭容器中充入1.0mol A,经一段时间后反应A(g)?B(g)+C(g)达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50 s内B的平均反应速率v(B)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol•L-1,则反应的△H<0 |
分析 A.根据v=$\frac{△c}{△t}$进行计算;
B.平衡常数与温度有关;
C.计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向;
D.与原平衡常数进行比较,判断温度对平衡的影响,依此进行解答.
解答 解:A.由表中数据可知50s内,△n(B)=0.16mol,v(B)=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/(L•s),故A错误;
B.温度相同,平衡常数保持不变,故B错误;
C.平衡时,n(B)=0.20mol,n(C)=0.20mol,n(A)=1.0-0.20=0.80mol,平衡常数K=$\frac{c(B)•c(C)}{c(A)}$=$\frac{\frac{0.2}{2}×\frac{0.2}{2}}{\frac{0.8}{2}}$=0.025mol•L-1,
相同温度下,向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则Qc=$\frac{\frac{0.2}{2}×\frac{0.2}{2}}{\frac{1.0}{2}}$=0.002mol•L-1<K,则反应正向进行,故v(正)>v(逆),故C正确;
D.若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol•L-1>0.025mol•L-1,故升高温度,平衡正向移动,故正反应为吸热反应,故△H>0,故D错误;
故选C.
点评 本题考查化学平衡计算应用,化学反应速率计算,难度中等.平衡常数的计算分析应用是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列气体溶于括号中的反应液不能形成喷泉的是( )
| A. | HCl (水) | B. | NH3(水) | ||
| C. | SO2(浓氢氧化钠溶液) | D. | Cl2(饱和食盐水) |
15.①pH=2的CH3COOH溶液;②pH=2的盐酸;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
17.下列说法不正确的是( )
| A. | 钠和钾的合金具有导电性,可用于中子反应堆热交换剂 | |
| B. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 |
 .
.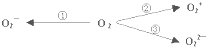 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.