题目内容
【题目】现有25mL 2molL﹣1 Na2CO3和75mL 1molL﹣1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中 ②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况是( )
A.均为0.84 L
B.均为0.56 L
C.①>②
D.②>①
【答案】C
【解析】解:n(Na2CO3)=0.025L×2mol/L=0.05mol,n(HCl)=0.075L×1mol/L=0.075mol,
将Na2CO3溶液逐滴加入到盐酸中,有关反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,
生成气体的体积为 ![]() ×0.075mol×22.4L/mol=0.84L,
×0.075mol×22.4L/mol=0.84L,
而将稀盐酸缓缓滴到Na2CO3溶液中,先发生Na2CO3+HCl═NaCl+NaHCO3 , 反应消耗0.05molHCl,剩余0.025molHCl,
盐酸过量时在发生NaHCO3+HCl═NaCl+CO2↑+H2O,则生成气体0.025mol×22.4L/mol=0.56L,
则①>②,
故选:C.
将Na2CO3溶液逐滴加入到盐酸中,有关反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,而将稀盐酸缓缓滴到Na2CO3溶液中,先发生Na2CO3+HCl═NaCl+NaHCO3 , 盐酸过量时在发生NaHCO3+HCl═NaCl+CO2↑+H2O,结合物质的量的关系解答.

 阅读快车系列答案
阅读快车系列答案【题目】回答下列问题
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
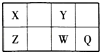
①某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背 , B元素位于周期表五个区域中的区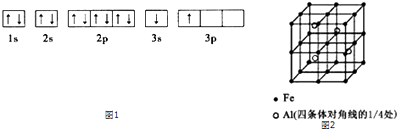
②ACl2分子中A的杂化类型为 , ACl2的空间构型为 .
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为 .
②写出一种与CN﹣互为等电子体的单质的电子式 .
③六氰合亚铁离子[Fe(CN)6]4﹣中不存在 .
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al﹣Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式 .
②若晶体的密度=ρ g/cm3 , 则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为cm.