��Ŀ����
����Ŀ����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ����Fe3+��I2�����ʵ�����n��Cl2���ı仯��ͼ��ʾ����ش��������⣺ 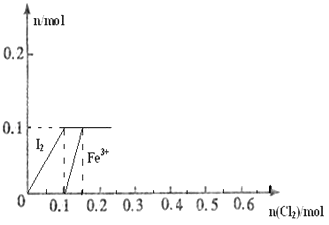
��1����ͼ��֪��I����Fe2+��I2�������ӵĻ�ԭ����ǿ������˳��Ϊ���� ��
��2����n��Cl2��=0.12molʱ����Һ�е�������ҪΪ �� �ӿ�ʼͨ��Cl2��n��Cl2��=0.12molʱ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
��3������Һ��n��Cl������n��IO3����=8��1ʱ��ͨ���Cl2�ڱ�״���µ����Ϊ ��
���𰸡�
��1��I����Fe2+��I2
��2��Fe2+��Fe3+��Cl����5FeI2+6Cl2=5I2��+2FeCl3+3FeCl2
��3��8.96L
���������⣺��1����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ��������ԭ��Ӧ�л�ԭ��Խǿ����Խ��Һʧ���ӣ��ɴ�˵��I����Fe2+��I2�������ӵĻ�ԭ����ǿ������˳��ΪI����Fe2+��I2 �� ���Դ��ǣ�I����Fe2+��I2����2������ͼ��Ϸ�ӦCl2+FeI2=FeCl2+I2֪����ͨ��0.1molCl2ʱ��������ȫ���������ɵⵥ�ʣ��⻯���������ʵ�����0.1mol����100mL FeI2��Һ����ͨ��Cl2 �� ����������Cl����I2��Fe3+��IO3�� �� ���Ե�ͨ��Cl2��n��Cl2��=0.12molʱ���������������ӷ�Ӧ���������ӣ�2Fe2++Cl2=2Fe3++2Cl�� �� ͨ�����������ʵ�����0.02molʱ����0.04mol�������ӱ���������ʣ0.06mol�������ӣ�������Һ�д��ڵ�������Fe2+��Fe3+��Cl�� �� ���������ӷ�Ӧ����ʽΪ5FeI2+6Cl2=5I2��+2FeCl3+3FeCl2 �� ���Դ��ǣ�Fe2+��Fe3+��Cl����5FeI2+6Cl2=5I2��+2FeCl3+3FeCl2����3����������ת��Ϊ���������ʱ������������ȫת��Ϊ�����ӣ������������ʵ�����x���������ӵ����ʵ�����8x������������ԭ��Ӧ�е�ʧ��������ȵ�x��6+��0.2��x����1+0.1��1=8x��1��x=0.1��������Һ�е���������ʵ�����0.1mol�������ӵ����ʵ�����0.8mol������Cl2��2Cl��֪�����������ʵ�����0.4mol�����������=0.4mol��22.4L/mol=8.96L�����Դ��ǣ�8.96L��