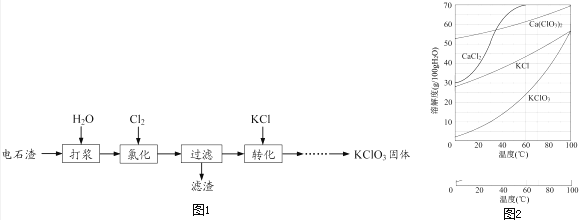
题目内容
【题目】从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快反应速率,不可以采取的措施有(填序号,下同). A.使用催化剂 B.提高氧气的浓度
C.提高反应的温度 D.降低反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是 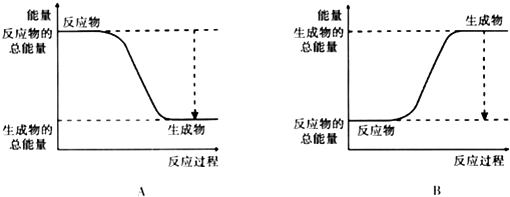
(3)从断键和成键的角度分析上述反应中能量的变化.已知化学键的键能如表:
化学键 | H﹣H | O=O | H﹣O |
键能kJmol﹣1 | 436 | 496 | 463 |
由此计算2mol H2在氧气中燃烧生成气态水放出的热量 .
【答案】
(1)A、B、C
(2)A
(3)484kJ
【解析】解:(1)A.使用催化剂,加快反应速率,故A选; B.适当提高氧气的浓度,反应物浓度增大,反应速率加快,故B选
C.适当提高反应的温度,反应速率加快,故C选;
D.适当降低反应的温度,反应速率减慢,故D不选;
所以答案是:ABC;(2)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,所以答案是:A;(3)断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH﹣O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和﹣生成物中键能之和=1368﹣1852kJ/mol=﹣484kJ/mol,即2mol H2在氧气中燃烧生成气态水放出的热量为484kJ,所以答案是:484kJ.
【考点精析】解答此题的关键在于理解吸热反应和放热反应的相关知识,掌握化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应,以及对反应热和焓变的理解,了解在化学反应中放出或吸收的热量,通常叫反应热.

 通城学典默写能手系列答案
通城学典默写能手系列答案