题目内容
【题目】为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
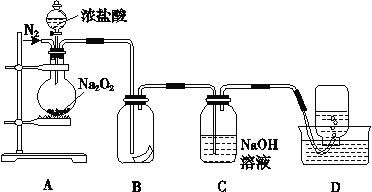
实验步骤及现象如下:
①检查装置气密性后,装入药品Na2O2并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸
入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条褪色,证明A中反应有______(填化学式)生成。若将B中红纸条改为湿润的紫石蕊试纸,现象为 _______
(2)实验前通N2的目的 ____,装置C的作用是_______
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,其不赞成的理由可能为: ①_______;②O2有可能是Na2O2与盐酸中的H2O反应所得.
【答案】Cl2先变红后变白排尽装置内的氧气和CO2吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气Na2O2被还原时氧元素的化合价应该降低,不可能得到O2
【解析】
(1)根据实验现象,反应产生黄绿色气体,以及B中的湿润布条褪色,说明有氯气生成;氯气和水反应生成盐酸和次氯酸,所以氯水溶液即有酸性,也有漂白性。
(2)后续实验需检验是否有氧气生成,而装置中残留氧气,空气中的二氧化碳也能与过氧化钠反应,所以需除去,所以实验前通N2的目的排尽装置内的氧气和CO2;在实验室制备并收集气体时,常需要添加洗气装置,以保证收集到的气体纯度较高,Cl2有毒不能直接排空,并且反应物HCl具有挥发性,结合氢氧化钠的性质分析C装置的作用。
(3)如果Na2O2被还原,则O元素应该得电子化合价降低,而得到氧气时氧元素的化合价是升高的,不可能发生此反应。
(1)反应产生的黄绿色气体能够使湿润的红色石蕊试纸先变红后变白,说明有HClO生成,同时生成盐酸,所以说明装置A中有Cl2生成,能够使装置B中湿润的红色纸条褪色;正确答案:Cl2;先变红后变白。
(2)后续实验需检验是否有氧气生成,而装置中残留氧气,空气中的二氧化碳也能与过氧化钠反应,所以需要除去,所以实验前通N2的目的排尽装置内的氧气和CO2;Cl2有毒不能直接排放到空气中,如果O2中混有Cl2,会导致收集的O2不纯净,且盐酸具有挥发性,导致生成的气体中含有HCl,氯气、HCl都能和NaOH反应而除去,则NaOH的作用是吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气;正确答案:排尽装置内的氧气和CO2 ;吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气。
(3) Na2O2中氧元素的化合价为-1价,Na2O2被还原时氧元素的化合价应该降低,不能是化合价升高,不可能得到O2;正确答案:Na2O2被还原时氧元素的化合价应该降低,不可能得到O2。

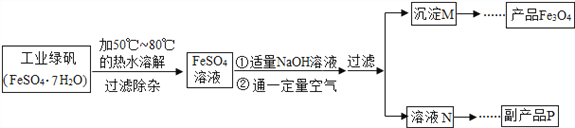
【题目】某化学兴趣小组对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图:
 【查阅资料】
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2 +2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2 + 2Fe(OH)3 ![]() Fe3O4+4H2O
Fe3O4+4H2O
Ⅰ【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是__________________________________________。
(2)副产品P是___________________________。
(3)为了得到纯净的产品,过滤、洗涤后进行的具体操作过程为______________________________、干燥
Ⅱ【组成确定】
资料显示:①铁的氢氧化物在受热时分解生成铁的氧化物(化合物不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的四氧化三铁的纯度,同学们称取了23.28g该Fe3O4样品设计下列实验进行探究。
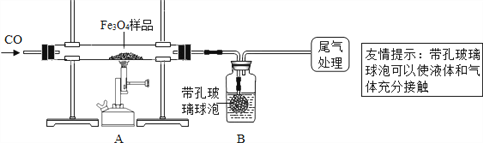
(1)该组同学欲通过称量B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质。B中的最佳试剂是_______________________(填序号)。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,以及B中的溶液倒吸入A中;且可以_____________________________,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中
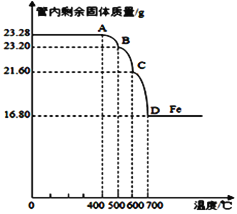
①该Fe3O4样品中含有的杂质成分______________________(填化学式)
②计算样品中Fe3O4的质量分数(写出必要的计算过程)。 _____________